Efecto de los campos magnéticos sobre el crecimiento y la viabilidad de los tumores
- by: Emile Wirngo
- August 2024
- 0 comentarios
Abstracto
El cáncer de mama es el cáncer no cutáneo más común y es la segunda causa principal de muertes relacionadas con el cáncer en mujeres. La mayoría de los métodos de intervención implican combinaciones de cirugía, quimioterapia y radiación ionizante. Tanto la quimioterapia como la radiación ionizante pueden ser eficaces contra muchos tipos de cáncer, pero también dañan los tejidos normales. El uso de campos magnéticos no ionizantes ha demostrado ser prometedor en varios estudios in vitro y en animales. Nuestro estudio probó el efecto de diferentes duraciones de exposición magnética en el crecimiento y la viabilidad del tumor en ratones inyectados con células de cáncer de mama. Las células cancerosas se marcaron a través de la expresión estable de luciferasa de luciérnaga para monitorear el crecimiento y la progresión del tumor utilizando un sistema de imágenes in vivo. Planteamos la hipótesis de que la exposición al campo magnético influiría en el crecimiento y la progresión del tumor. Nuestros resultados mostraron que la exposición de los ratones a campos magnéticos durante 360 minutos diarios durante 4 semanas suprimió el crecimiento del tumor. Nuestro estudio es único en el sentido de que utiliza un sistema de imágenes in vivo para monitorear el crecimiento y la progresión de los tumores en tiempo real en ratones individuales. Nuestros hallazgos respaldan una mayor exploración del potencial de los campos magnéticos en la terapia contra el cáncer, ya sea como terapia complementaria o primaria.
En los Estados Unidos, el cáncer de mama es el cáncer no cutáneo más común y es la segunda causa principal de muertes relacionadas con el cáncer en las mujeres. Cada año se destinan importantes fondos a la investigación del cáncer. 1 La mayoría de los métodos de intervención implican combinaciones de cirugía, quimioterapia y/o radiación ionizante. Incluso cuando se elige la cirugía como método principal, a menudo se emplean estas últimas terapias porque no se sabe con certeza la extensión de la enfermedad o es evidente la presencia de metástasis. Tanto la quimioterapia como la radiación ionizante pueden ser eficaces contra muchos tipos de cáncer, pero también dañan o destruyen los tejidos normales. Debido a esta limitación, el uso de dosis lo suficientemente altas como para matar todas las células cancerosas puede resultar imposible sin producir también una morbilidad grave y posiblemente mortal.
El uso de campos magnéticos no ionizantes ha demostrado ser prometedor en una serie de estudios in vitro y en animales, y justifica un ensayo minucioso, ya sea que en última instancia tenga un papel como terapia complementaria o incluso un papel primario en ciertas formas de cáncer humano. 2 , 5 , 10 , 17 - 19 , 21 Una ventaja potencial adicional es que los campos magnéticos tienen el potencial de causar menos daño a los tejidos normales. Nuestro estudio probó el efecto de los campos magnéticos en el crecimiento de células cancerosas. Investigamos múltiples niveles de exposición utilizando ratones a los que se les habían inyectado células de cáncer de mama de ratón. Las células cancerosas se marcaron bioluminiscentemente mediante la expresión de la enzima luciferasa, que se pudo identificar a través de un sistema de imágenes in vivo. El crecimiento y la propagación de los tumores resultantes en los ratones inoculados se observaron con el sistema de imágenes ópticas in vivo que monitoreó la progresión del tumor en un solo animal en tiempo real. Nuestros resultados pueden conducir al desarrollo de métodos más nuevos y menos tóxicos de terapias primarias o complementarias contra el cáncer.
Materiales y métodos
Ratones.
El estudio se llevó a cabo en el centro de animales acreditado por AAALAC en el Programa de Medicina Comparativa de la Facultad de Medicina de la Universidad de Maryland (Baltimore, MD). Todos los procedimientos se llevaron a cabo de acuerdo con las pautas de la Guía para el cuidado y uso de animales de laboratorio 6 y las políticas del IACUC de la instalación. Todos los procedimientos cumplieron con las normas de los CDC/NIH Bioseguridad en laboratorios microbiológicos y biomédicos . 4 En este estudio se utilizaron ratones hembra desnudos de raza suiza (Cr:NIH(S)- nu/nu ; edad, 3 a 4 semanas; Instituto Nacional del Cáncer, Frederick, MD). Los ratones se alojaron en jaulas de microaislamiento intraventiladas con ropa de cama. Todos los ratones tuvieron a su disposición alimento (esterilizado en autoclave) y agua (hiperclorada) ad libitum durante todo el período del estudio. Se puso en marcha un programa de vigilancia que mantiene las instalaciones de los ratones libres de patógenos adventicios.
Células.
La línea celular de tumor de mama metastásico de ratón EpH4-MEK-Bcl2 13 Se utilizó un método de inyección a ratones a través de la almohadilla de grasa mamaria con 1 × 10 6 Células. Las células se transfectaron con un vector de expresión de luciferasa (pβP2-PolII-luciferasa) antes de la inyección. Las células se cultivaron asépticamente en condiciones de nivel 2 de bioseguridad y se confirmó que estaban libres de VIH, virus de la hepatitis B y C y patógenos adventicios de ratón como rotavirus de ratón (diarrea epizoótica de ratones lactantes), virus de la hepatitis de ratón, parvovirus de ratón, virus diminuto de ratones, proteína no estructural 1 de parvovirus, virus de la ectromelia, virus de la encefalomielitis murina de Theiler, virus de la coriomeningitis linfocítica, adenovirus de ratón, Mycoplasma , virus polioma, reovirus tipo 3 y virus Sendai.
Diseño experimental.
En este estudio se utilizaron un total de 21 ratones. Para evaluar el efecto del campo magnético en la salud general de los animales, realizamos un estudio preliminar con 9 ratones. Los ratones se dividieron en 3 grupos (3 ratones por grupo) y se expusieron a campos magnéticos unipolares de media onda sinusoidal de 100 mT y 1 Hz. Los 3 grupos estuvieron expuestos al campo magnético directamente todos los días durante 60, 180 o 360 minutos. Se observó a los ratones para detectar cualquier signo de enfermedad clínica o pérdida de peso. Todos los ratones fueron sacrificados al final del estudio y se recolectaron tejidos para análisis histopatológico. En la siguiente parte del estudio, los ratones se dividieron en 4 grupos (3 ratones por grupo). A los ratones se les inyectó la línea celular de cáncer de mama de ratón EpH4-MEK-Bc12 marcada con luciferasa (1 × 10 6 células suspendidas en 100 μL de PBS estéril). Los ratones del grupo de control negativo (NCG) fueron inoculados con la línea celular cancerosa pero no expuestos a campos magnéticos. Los ratones de los 3 grupos restantes fueron expuestos diariamente a campos magnéticos unipolares de media onda sinusoidal de 100 mT y 1 Hz durante 4 semanas. El tiempo de exposición fue de 60 min (grupo G60), 180 min (G180) o 360 min (G360). Niveles de exposición similares habían sido bien tolerados en experimentos anteriores. 5 , 19 Todos los ratones fueron sacrificados en la cuarta semana del estudio. Todos los ratones fueron alojados en una habitación que no contenía la fuente de imán. Los grupos tratados fueron llevados diariamente a la habitación que contenía el imán durante períodos de tiempo variables para la exposición magnética y luego regresaron a la habitación donde se alojaban los animales. El grupo de ratones no tratados no fue llevado a la habitación que contenía el imán. El efecto de los campos magnéticos en los ratones inoculados se evaluó comparando los grupos expuestos con el grupo no expuesto.
El sistema de exposición (dispositivo magnético) utilizó una bobina de Helmholtz refrigerada por agua accionada por una fuente de alimentación de corriente alterna de alta potencia controlable (SDR TH 40-250, Sodilec, Burdeos, Francia) cuya forma de onda de salida podía ajustarse mediante un generador de señal externo. Las bobinas de Helmholtz tenían un diámetro interior de 152 mm, un diámetro exterior de 406 mm y una separación de 83 mm. Cada bobina tenía una resistencia de 0,42 Ω. Con las bobinas conectadas en paralelo a 20 V, la corriente de accionamiento nominal era cercana a 100 A y producía un campo de corriente continua de 0,094 T. Este instrumento nos fue prestado generosamente por el profesor Bernard Veyret (Universidad de Burdeos, Francia). Para las exposiciones que se informan en este documento, la fuente de alimentación se moduló con un generador de onda cuadrada y produjo una forma de onda de campo magnético que era una onda sinusoidal unipolar de medio ciclo. Los semiciclos tenían una duración de 0,5 s con una frecuencia de repetición de 1 Hz y un campo pico de 0,1 ± 0,006 T. El campo magnético se midió utilizando 2 sondas diferentes (MAG-03 MC, Bartington, Witney, Reino Unido, y modelo 5180, FW Bell, Milwaukie, OR). La sonda Bell se utilizó para calibrar la bobina de Helmholtz durante las pruebas de corriente continua, porque podía registrar los grandes campos producidos. La sonda Bartington tuvo una respuesta mucho más rápida y se utilizó cerca del imán, pero no en la región del campo pico, para medir la variación temporal precisa del campo. La progresión y propagación de los tumores en los ratones inoculados se monitorizaron y midieron utilizando un sistema de imágenes in vivo (Xenogen IVIS 200, Alameda, CA). Los tamaños de los tumores se midieron utilizando calibradores.
Progresión del crecimiento del tumor.
Se monitoreó el crecimiento del tumor en los ratones una vez cada 2 a 4 días durante el transcurso de 4 semanas con imágenes de bioluminiscencia de cuerpo entero durante 2 a 3 minutos utilizando el sistema de imágenes in vivo. Este novedoso sistema de imágenes no invasivo detectó células tumorales vivas marcadas con luciferasa, lo que permitió el monitoreo en tiempo real del crecimiento y la propagación del tumor en los ratones. Para la toma de imágenes, los ratones fueron sedados con isoflurano al 2% en oxígeno al 100% a 3,5 L/min (para la inducción) en la cámara de anestesia del sistema de imágenes. Se tomaron imágenes cada 3 minutos como una secuencia de 10 imágenes para cada grupo de ratones, 2 veces por semana durante un total de 4 semanas. La progresión y la propagación de los tumores se evaluaron mediante los valores promedio de radiancia máxima de los tumores de los ratones inoculados. Los tamaños de los tumores se midieron utilizando calibradores semanalmente.
Análisis estadístico.
Comparamos los valores promedio de radiancia máxima de los tumores (medidos en fotones/s/ cm2 /estereorradián, es decir, p/s/ cm2 /sr) de todos los grupos de ratones mediante ANOVA. Usamos pruebas de rango múltiple de Duncan para comparar las diferencias en la radiancia máxima promedio entre los grupos. Todos los análisis estadísticos se realizaron utilizando SAS 9.1 (Cary, NC). El aumento medio de los valores de luminiscencia se comparó utilizando a pruebas. La significación estadística se definió como una PAG valor inferior a 0,05.
Eutanasia y evaluación patológica.
Todos los ratones fueron sacrificados por asfixia con una sobredosis de gas de dióxido de carbono seguida de dislocación cervical el día 28 (punto final) del estudio. Los puntos finales alternativos en este estudio incluyeron animales que mostraban signos de malestar como letargo, incapacidad para moverse debido al aumento de tamaño o ubicación de los tumores, deshidratación, inapetencia y pérdida de peso grave o animales que desarrollaron ulceración de los tumores o tenían tumores de más de 2 cm de diámetro. Los ratones que mostraron estos signos fueron sacrificados antes del punto final del estudio. Se recogieron tejidos como piel, hígado, pulmón, bazo y tumores de cada animal en la eutanasia. Se recogieron muestras de piel, hígado, pulmón y bazo de ratones en el estudio preliminar, que se realizó para evaluar el efecto del campo magnético en la salud general de los animales. Las secciones de parafina de tumores fijados con formalina se tiñeron con hematoxilina y eosina y fueron evaluadas por un patólogo veterinario certificado.
Ensayo de muerte celular.
Para comprobar si el mecanismo de muerte celular en tumores se debía a la apoptosis, se analizaron secciones tumorales embebidas en parafina mediante ensayos de marcaje de extremos de mella de dUTP mediado por desoxinucleotidil transferasa terminal (TdT) (TUNEL) para detectar células apoptóticas (realizado en Histoserve, Germantown, MD). Brevemente, los bloques se desparafinaron con xileno y etanol graduado y se lavaron con agua destilada. A continuación, los portaobjetos se trataron con proteinasa K seguida de EDTA, se lavaron con agua destilada y se bloquearon con albúmina de suero bovino. Los portaobjetos se incubaron con tampón de equilibrio a 37 °C y se lavaron con tampón SSC 1×. Los portaobjetos se bloquearon con albúmina de suero bovino y se sometieron a tratamiento con antidigoxina (1:1000; número de catálogo 1093274, Roche Diagnostics, Indianápolis, IN). El color se reveló con fucsina, seguido de una contratinción con hematoxilina. Los portaobjetos se deshidrataron con etanol graduado y se aclararon con solución ClearRite (Thermo Fisher Scientific, Kalamazoo, MI). Los cubreobjetos se montaron utilizando el medio de montaje Permount (Fisher Scientific, Pittsburg, PA).
Resultados
Lesiones tumorales macroscópicas.
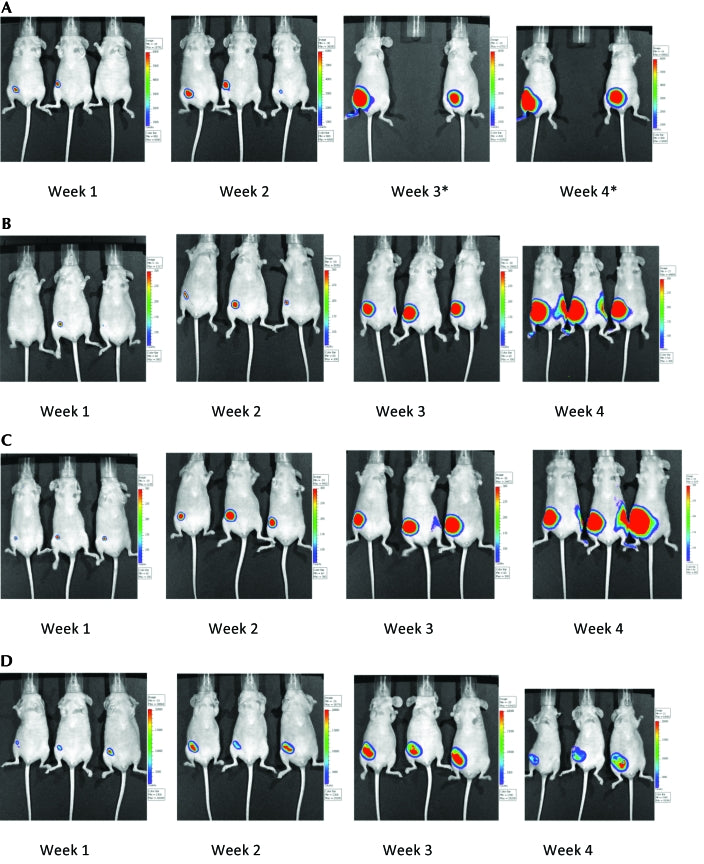
El crecimiento y la progresión del tumor en los grupos de control y de estudio de ratones se evaluaron como el aumento medio del valor de luminiscencia en comparación con la semana 1 (calculado normalizando los valores promedio de radiancia máxima). Los ratones inoculados que no fueron expuestos a la radiación magnética (grupo NCG) tenían tumores muy grandes. Los ratones NCG tuvieron un aumento de 500 veces en el crecimiento del tumor en la semana 4 en comparación con la semana 1. El crecimiento del tumor de los ratones en los grupos G60 y G180 también mostró aumentos robustos (900 y 200 veces, respectivamente) en la semana 4 en comparación con la semana 1 del estudio. Por el contrario, el grupo G360 mostró solo un aumento de 44 veces en su crecimiento del tumor en la semana 4 en comparación con la semana 1. Además, los tumores en los ratones G360 incluyeron áreas extensas de necrosis ( Tabla 1) . La progresión de los tumores en ratones pertenecientes a los grupos G60 y G180 no difirió de la de los ratones no tratados (NCG) ( Figura 1) . Sin embargo, los ratones que fueron tratados con 360 min de campo magnético mostraron una supresión del crecimiento tumoral ( Figura 1 ). La Figura 1 también muestra una clara tendencia hacia la supresión tumoral con el aumento del tratamiento con campo magnético. Figura 2 Compara el crecimiento y la progresión de tumores en ratones de los diferentes grupos en la semana 4. Un ratón NCG fue sacrificado en la semana 3 del estudio porque alcanzó su punto final alternativo para la eutanasia. Las mediciones con calibrador indicaron que los ratones NCG mostraron los tumores más grandes, seguidos por los ratones de los grupos G360, G60 y G180 (datos no mostrados).
Tabla 1.
Mediciones de pliegues promedio normalizadas de la radiancia promedio máxima (p/s/cm 2 /sr) en ratones inoculados con células de cáncer de mama de ratón
| Grupo | Semana 1 | Semana 2 | Semana 3 | Semana 4 |
| G60 | 1.0 | 5.69 | 80,58 | 979.33 |
| G180 | 1.0 | 8.16 | 51,95 | 236,48 |
| G360 | 1.0 | 9.06 | 29.40 | 44.02 |
| NCG | 1.0 | 14.25 | 206.67 | 523,53 |
Aumento de la luminiscencia en pliegues (media ± SEM en comparación con el valor de la semana 1) en tumores sometidos a diferentes tratamientos con campos magnéticos. Los tumores en ratones tratados durante 60 min (G60) o 180 min (G180) no difirieron significativamente de los de los ratones no tratados (NCG). Los ratones tratados durante 360 min (G360) mostraron un aumento significativo ( t prueba, PAG < 0,05) supresión del crecimiento tumoral.
Crecimiento y progresión de tumores en ratones inoculados con células cancerosas de ratón y ( A) no expuestos a radiación magnética (grupo NCG; un ratón de este grupo tuvo que ser sacrificado en la semana 3 y, por lo tanto, no se incluyó en el resto del estudio) o expuestos a (B) 60 min (grupo G60), (C) 180 min (grupo G180) o (D) 360 min (grupo G360) de radiación magnética diariamente durante un período de 4 semanas. Las fotografías se tomaron a intervalos semanales utilizando el sistema de imágenes in vivo.
Histopatología.
Los tumores en todos los grupos de ratones eran carcinomas poco diferenciados con diferenciación mamaria limitada. La mayoría de los tumores tenían áreas prominentes de necrosis con infiltración de leucocitos polimorfonucleares. Los tumores en el grupo G360 tenían áreas de necrosis más extensas en comparación con los ratones del grupo NCG ( Figura 3 ). Los ensayos TUNEL mostraron que el mecanismo de muerte celular en algunas células de estos tumores puede haber sido la apoptosis. Estas células mostraron núcleos fragmentados característicos de la muerte celular programada ( Figura 4 ). Los ratones que no fueron inoculados con células cancerosas pero expuestos a campos magnéticos no mostraron ninguna anomalía histopatológica en sus tejidos de pulmón, hígado o piel (glándula mamaria) ( Figura 5 ). Además, ninguno de los órganos de ninguno de los grupos de ratones mostró ninguna patología macroscópica en la necropsia.
Secciones de tumores [aumento, ×20 (izquierda) y ×400 (derecha)] de ratones del grupo NCG (panel superior) y del grupo G360 (panel inferior) en la semana 4 del estudio. Nótese las extensas áreas de necrosis (N) en el grupo G360 en comparación con las áreas necróticas en los tumores de los ratones NCG.
Sección de un tumor de un ratón G360 (panel derecho) en la semana 4. Se utilizó el ensayo TUNEL para revelar núcleos fragmentados (teñidos de rojo y marcados con flechas negras) en células apoptóticas. Se muestra un control positivo (panel izquierdo) que muestra células apoptóticas para comparación. Aumento, ×200.
Discusión
Utilizamos ratones desnudos suizos inmunodeficientes a las células T para investigar el efecto de los campos magnéticos en el crecimiento y la viabilidad de los tumores. Nuestros datos muestran que las células tumorales de mama de ratón crecieron más rápidamente hasta convertirse en tumores visibles en el grupo de ratones no expuestos en comparación con los expuestos a campos magnéticos. El sistema de imágenes in vivo que utilizamos detecta células tumorales vivas en los diversos grupos de ratones (es decir, mide la propagación y la progresión de los tumores en tiempo real). Los tumores fueron más grandes (mediciones con calibrador) y crecieron más rápidamente (resultados de las imágenes) en los ratones no expuestos (grupo NCG). Aunque los tamaños de los tumores fueron comparativamente mayores en los ratones expuestos a campos magnéticos durante 360 minutos diarios (grupo G360) que en los expuestos durante 60 o 180 minutos, los ratones G360 mostraron disminuciones en las tasas de crecimiento y progresión del tumor. Además, este grupo de ratones tenía las áreas más extensas de necrosis, como lo evidencian los datos histopatológicos. Debido a que el sistema de obtención de imágenes detecta únicamente células tumorales vivas, los valores de bioluminiscencia de los ratones G360 fueron menores que los de los otros grupos. Los tumores de los ratones pertenecientes a los grupos NCG, G60 y G180 mostraron aumentos en el tamaño y el crecimiento del tumor cuando se midieron durante un período de 4 semanas. Estos hallazgos brindan información sobre los efectos de la exposición al campo magnético en el crecimiento y la viabilidad del tumor.
Aunque las terapias dirigidas, especialmente el uso de medicamentos "de diseño", están siendo objeto de intensa investigación, su eficacia final aún no se ha establecido. 8 , 12 , 16 Estudios previos sobre los efectos reductores de tumores de los campos magnéticos representan una gran variedad en sistemas de cultivo celular, modelos animales (ratones), fuentes de campo, formas de onda, intensidades de campo y protocolos de exposición. Muchos de los estudios de cultivos celulares de líneas tumorales informan una muerte celular significativa después de la exposición magnética en comparación con la de los cultivos de control. Con algunas excepciones, la mayoría de los estudios in vivo han informado una reducción relativa en el tamaño del tumor en tumores expuestos a campos magnéticos en comparación con los controles. 3 , 5 , 9 , 10 , 11 , 17 - 21 La reducción del tamaño del tumor se produce en una amplia variedad de intensidades de campo, formas de onda, duraciones de exposición, modelos animales, líneas tumorales y otros aspectos de procedimiento. Ninguna teoría general ha explicado una respuesta tan ubicua, aunque se han observado una serie de cambios bioquímicos y estructurales celulares 3 Se han documentado ampliamente. Un informe describe la inhibición de la proliferación de células tumorales in vitro 14 en presencia de un campo magnético estático.
Dado que se han observado efectos de reducción de tamaño con muchas formas de onda diferentes, un objetivo importante debería ser encontrar la forma de onda con actividad óptima. Un estudio previo 3 Se investigó la adición de campos magnéticos a la radiación ionizante o la quimioterapia. En el estudio actual, nuestro objetivo general fue encontrar un régimen óptimo de exposición a campos magnéticos que proporcione la eliminación más eficiente de células cancerosas, es decir, evaluar el potencial máximo de los campos electromagnéticos en primera instancia y luego evaluar su papel, al diseñar estudios clínicos, ya sea como terapia complementaria o primaria.
Un estudio previo informó que la exposición a campos electromagnéticos terapéuticos redujo significativamente el crecimiento del tumor y la extensión de la vascularización del tumor, con un aumento concomitante en la extensión de la necrosis tumoral. 19 Los autores 19 Concluyeron que este tratamiento redujo de forma segura el crecimiento y la vascularización de los cánceres de mama implantados en ratones y que los campos electromagnéticos terapéuticos pueden resultar un complemento útil para aumentar el índice terapéutico de la terapia convencional contra el cáncer. Los resultados de nuestro estudio actual concuerdan con este estudio previo. 19 En comparación con nuestro estudio, el estudio anterior 19 Se utilizaron exposiciones a campos de menor intensidad (15 y 20 mT) y períodos de exposición mucho más cortos (10 minutos por día). El régimen de exposición óptimo sigue siendo desconocido. Creemos que las exposiciones más débiles y breves a los campos magnéticos tienen menos probabilidades de tener un efecto, en comparación con las exposiciones más prolongadas y más fuertes. Otro estudio 21 Investigaron el efecto de la radiación magnética sobre tumores en ratones inyectados con células ascíticas de sarcoma. Los sarcomas se formaron entre 4 y 5 días después de la inoculación. Los ratones fueron expuestos a campos magnéticos de gradiente pulsado de 0,6 a 2,0 T con un gradiente de 10 a 200 T/m, ancho de pulso de 20 a 200 ms y frecuencia de 0,16 a 1,34 Hz durante 15 minutos al día durante 28 días, 21 En ese momento, los ratones fueron sacrificados. El peso medio del tumor de los animales tratados fue de 1,40 ± 0,81 g en comparación con 2,45 ± 0,95 para los animales de control, una diferencia estadísticamente significativa. La microscopía mostró una necrosis extensa en secciones del tumor y evidencia asociada de apoptosis en muestras de animales tratados.
Las numerosas diferencias en la forma de onda, la intensidad, la duración de la exposición y la evaluación de la respuesta impiden la comparación directa entre los resultados de los estudios actuales y los anteriores. 3 , 5 , 9 , 10 , 11 , 17 - 21 De todos modos, en cada caso el resultado pareció ser una reducción relativa del tamaño del tumor, probablemente a través de la citorreducción, y la aparición de necrosis tumoral. Sobre la base de estos y otros estudios asociados, la apoptosis parece desempeñar un papel importante, y se puede sospechar firmemente una propiedad antiangiogénica de los campos. Para investigar los posibles mecanismos de muerte celular en los tumores, incluida la apoptosis, realizamos ensayos TUNEL en secciones tumorales de nuestros ratones. Nuestros resultados indican que la apoptosis puede haber desempeñado un papel en la muerte celular en los tumores ( Figura 4 ). Un estudio previo 3 Se ha demostrado que los campos magnéticos pueden inhibir el crecimiento tumoral al inhibir la angiogénesis y bloquear el suministro de sangre a los tejidos tumorales. Creemos que la muerte celular y la necrosis observadas en los tumores de nuestros ratones pueden deberse al efecto combinado de la supresión de la angiogénesis, el bloqueo del suministro de sangre a los tejidos tumorales y la muerte celular debido a la apoptosis.
Estudios previos 3,4 No se ha informado de morbilidad o mortalidad ni de anomalías en los tejidos normales debido a la exposición a campos magnéticos. En nuestro estudio, los ratones expuestos a campos magnéticos durante 60, 180 o 360 minutos al día no mostraron ningún signo de enfermedad clínica ni pérdida de peso (datos no mostrados). Los tejidos recolectados de estos ratones en la necropsia no mostraron ninguna anomalía macroscópica ni histopatológica ( Figura 5 ). Estos hallazgos respaldan la probabilidad de que la exposición a campos magnéticos no sea perjudicial para la salud general de los ratones.
En resumen, informamos que la exposición directa de ratones a campos magnéticos redujo el crecimiento y la progresión tumoral. Los ratones expuestos a campos magnéticos durante 360 minutos diarios durante 4 semanas mostraron extensas áreas de necrosis en sus tumores. Los ratones del grupo de control no expuesto desarrollaron tumores grandes. Además, el tiempo de exposición de estos tumores a los campos magnéticos es crítico. Los ratones expuestos durante períodos más cortos (es decir, 60 o 180 minutos diarios por semana) no mostraron una reducción en el tamaño o el crecimiento del tumor. La principal debilidad de nuestro estudio fue el pequeño número de animales utilizados en cada grupo. Nuestro objetivo fue realizar un estudio preliminar para evaluar los efectos de los campos magnéticos en el crecimiento y la viabilidad del tumor. Además, queríamos optimizar el tiempo y la duración de la exposición al campo magnético. Informes previos 2 , 3 , 7 , 15 , 17 nos lleva a plantear la hipótesis de que se deberían intentar tiempos de exposición mucho más prolongados durante varios meses.
Nuestros hallazgos, junto con los informes de otros, respaldan una mayor exploración del potencial de los campos magnéticos en la terapia contra el cáncer, ya sea como terapia complementaria o, en algunos casos específicos aún por determinar, como terapia primaria. En particular, se deben explorar tiempos de exposición prolongados y diferentes intensidades de campo y formas de onda.
Expresiones de gratitud
Agradecemos al profesor Bernard Veyret de la Universidad de Burdeos, Francia, quien nos prestó el imán utilizado para este estudio. También agradecemos a Rebecca Yerkey, Elisa Luna, Dawn McKenna, Theresa Alexander y Leisha Alexander por brindarnos un excelente apoyo técnico veterinario.
Referencias
Publicación anterior
Usando imanes para matar el cáncer
Buscar
Publicación reciente
-
Meet Mammopadz – A Game Changer for Women
- Oct 13, 2024
-
Why Mammopadz is Essential for Every Woman
- Oct 13, 2024
-
How Mammopadz Supports Daily Breast Health Efforts
- Oct 13, 2024
Hoja informativa
Infórmese sobre nuestras noticias, actualizaciones y ofertas más recientes suscribiéndose.













