¿Fueron útiles los materiales magnéticos en la terapia del cáncer?
Abstracto
El cáncer es uno de los principales desafíos que enfrenta la investigación básica biomédica en nuestro tiempo. El estudio y desarrollo de estrategias terapéuticas efectivas para la terapia del cáncer son vitales. Entre los muchos componentes básicos probables de las nanopartículas , las nanopartículas basadas en magnetita han sido ampliamente estudiadas para la terapia del cáncer debido a sus características magnéticas inherentes, diseño multifuncional, propiedades biodegradables y biocompatibles. Las nanopartículas magnéticas también se han diseñado para su uso como agentes potenciadores del contraste para imágenes por resonancia magnética, sistemas de administración de fármacos y, más recientemente, como un elemento terapéutico para inducir la muerte celular en terapias de ablación de tumores. Esta revisión tuvo como objetivo proporcionar una descripción general de las diversas aplicaciones de las nanopartículas magnéticas y los logros recientes en el desarrollo de estos materiales avanzados para la terapia del cáncer.
Palabras clave
1. Introducción
La aparición de la ciencia y la tecnología a escala nanométrica se ha promocionado ampliamente como un cambio de paradigma exhaustivo para el diagnóstico y el tratamiento del cáncer. Sin duda, el aumento de los trabajos de investigación que investigan la síntesis de sistemas nanoparticulados ha permitido la formación de diversas formulaciones de materiales que muestran efectos diagnósticos y terapéuticos prometedores para el tratamiento de muchos tipos de cáncer en un único fármaco nanométrico. [1] , [2] , [3] Las configuraciones de nanopartículas consisten en aquellas con núcleos principales de moléculas orgánicas, moléculas inorgánicas o una combinación de dos o más de estos elementos [4] , [5] , [6] Todas las estructuras básicas tienen algunas ventajas y desventajas que dependen del uso previsto. Además, estas formulaciones tienen propiedades como, por ejemplo, carga superficial, hidrofobicidad y tamaño que se pueden ajustar, lo que permite mejorarlas para una función preferida [7] [8] .
Las nanopartículas magnéticas (MNP) son un grupo importante de nanopartículas (NP) que generalmente se construyen a partir de iones de metales puros o una mezcla de polímeros [9] , [10] Los exosomas, nanopartículas formadas naturalmente, se secretan de forma endógena a partir de las células tras la fusión de un compartimento endocítico intermedio y se han identificado como vehículos excepcionales para la administración de genes y fármacos. [11] Varios estudios han informado que los exosomas pueden aislarse de medios de cultivo celular, particularmente de cultivos de células tumorales. [12] . Sin embargo, estas células secretan pocos exosomas y pueden ofrecer funciones estimulantes del cáncer y del sistema inmunológico debido a sus ácidos nucleicos y cargas proteicas de las células donantes [13] , [14] Recientemente, se desarrolló un grupo de nanopartículas de óxido de hierro superparamagnéticas (SPION) basadas en exosomas como vehículo de administración de fármacos dirigidos para el tratamiento del cáncer. Se reveló que la administración de fármacos basada en exosomas aumentó la focalización del cáncer bajo un campo magnético externo y reprimió el tumor [11] .
Las MNP tienen muchas aplicaciones biomédicas, como la liberación controlada de fármacos [15] y la biodetección. [16] , tratamiento del cáncer con hipertermia [17] , imágenes por resonancia magnética (IRM) [18] Otra aplicación de las MNP es la obtención de imágenes por partículas magnéticas (MPI). La MPI es una nueva técnica de obtención de imágenes con la capacidad de detectar células cancerosas en diferentes tejidos. Las acumulaciones de NP en tejidos cancerosos en comparación con otros sitios pueden detectar tejidos cancerosos. Esta capacidad depende de la forma y las características físicas o químicas de las NP y de su generación de señales. La biodistribución de partículas magnéticas se puede evaluar mediante emisión de fotón único y fluorescencia en el infrarrojo cercano. Las partículas de óxido de hierro son materiales eficientes para la obtención de imágenes con alta sensibilidad y los polímeros son compatibles y degradables en el cuerpo [19] . La principal ventaja de las MNP es su capacidad de ser manipuladas magnéticamente con un campo magnético externo. La morfología, la composición química, la forma, el tamaño y el comportamiento magnético de las MNP son los criterios más importantes en la determinación de sus usos biomédicos. [10] Además, las propiedades magnéticas y la eficacia de las MNP in vivo se pueden adaptar utilizando un recubrimiento biocompatible y seguro para mejorar su idoneidad para un objetivo específico en el cuerpo humano [20] . Este recubrimiento puede formar varias estructuras para apuntar a células o moléculas específicas y se utiliza para obtener imágenes de ellas. Los enfoques de modificación de la superficie pueden conducir a la multifuncionalidad de las MNP. [21] , [22] . Dado que la modificación química ofrece una funcionalidad multiplexada, por ejemplo, administración combinada de fármacos para hipertermia e imágenes multimodales. [20] , [23] , [24] .
Se ha revelado que la fiebre podría afectar negativamente el crecimiento de las células cancerosas. [25] Además, las células cancerosas y no cancerosas muestran un comportamiento diferente en un rango de temperatura de 42 °C a 45 °C. Las células no cancerosas pueden soportar estas temperaturas durante un corto tiempo, mientras que las células cancerosas experimentan apoptosis. [26] . Por lo tanto, mantener la temperatura del entorno celular en hipertermia podría ser una forma eficaz de terapia contra el cáncer con menores efectos secundarios [27] . Las MNP tienen un gran potencial para crear calor bajo campos magnéticos y aumentar la temperatura del tumor canceroso a 42–45 °C. [28] . Por lo tanto, la hipertermia se utiliza actualmente en el tratamiento de muchos tipos de cáncer, como el cáncer de útero, el de próstata y el de mama. [29] , [30] , [31] , [32] .
Otra aplicación de las MNP es en la resonancia magnética para mejorar la focalización del tejido. [33] . Podrían localizarse en los sitios de tejido para mejorar la relajación de protones y aumentar su visibilidad. [34] . Consideradas como un material de próxima generación en MRI, las MNP se utilizan para la obtención de imágenes que contienen partículas nanocristalinas que podrían estar más funcionalizadas con materiales de recubrimiento y ligandos funcionales. Una medición más precisa y eficiente de células y biomarcadores es fundamental para el diagnóstico rápido y la prevención de la metástasis. El diagnóstico temprano del cáncer puede evitar considerablemente el crecimiento del cáncer y su metástasis a otro tejido [34] . Las herramientas de evaluación del cáncer con gran sensibilidad para detectar algunas fracciones de destino diferentes que necesitan una preparación mínima de la muestra para promover un diagnóstico considerablemente rápido. El uso de MNP en biosensores ha sido ampliamente investigado. Estos sistemas proponen ventajas únicas sobre los enfoques de detección convencionales. [3] , [35] .
Esta revisión está dedicada a discutir los avances recientes en el empleo de materiales basados en materiales magnéticos, incluidos materiales de óxido de hierro superparamagnético , materiales magnéticos basados en sílice, materiales de oro magnéticos, materiales basados en quitosano magnético, materiales basados en metales magnéticos, materiales basados en carbono magnético, materiales modificados con polietilenglicol (PEG) magnético, polímeros biocompatibles y otros materiales magnéticos para el monitoreo y diagnóstico del cáncer a través de modalidades de imágenes, la terapia del cáncer a través del transporte de agentes bioterapéuticos y quimioterapéuticos, terapias fototérmicas e hipertermia magnética.
2. Aplicaciones de materiales magnéticos avanzados para la terapia del cáncer
El uso de materiales de base magnética en aplicaciones biomédicas tiene un gran potencial en el campo de la terapia contra el cáncer. En particular, existen numerosas propiedades de los nanomateriales de base magnética, entre ellas una gran superficie y propiedades ópticas únicas que permiten el desarrollo de nuevos ensayos de tratamiento del cáncer [36] . Revisaremos estas características dependientes del material de las nanopartículas en relación con su eficacia en la terapia contra el cáncer mediante hipertermia, administración de fármacos, etc.
2.1. Materiales basados en nanopartículas de óxido de hierro superparamagnético para la terapia del cáncer
Las nanopartículas de óxido de hierro superparamagnético (SPION) son plataformas transportadoras de fármacos favorables debido a su alta biocompatibilidad , T 1 y efectos de contraste T2 para MRI, funcionalidades de superficie flexible y suspensiones coloidales estables in vivo [37] , [38] , [39] Además, las SPION pueden metabolizarse y biodegradarse sin acumularse en el organismo. [34] La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) proporcionó varios tipos de SPION para uso clínico. [40] A continuación se analizan ejemplos recientes de materiales basados en SPION para la terapia del cáncer.
Zuvin y otros. [41] demostraron los efectos anticancerígenos de los SPION recubiertos con ácido poliacrílico en células tumorales de mama a una intensidad de campo magnético baja de 0,8 kAm -1 mediante la unión del anticuerpo anti-HER2 a las NP. Las NP modificadas fueron internalizadas con éxito por las líneas celulares MDA-MB-453 y SKBR3 HER2-positivas. Las células cancerosas que sobreexpresaban HER2 fueron atacadas y luego destruidas por un SPION conjugado con anticuerpo anti-HER2 mediante hipertermia realizada a través de la inducción bajo magnitudes e intensidades de campo magnético más bajas. Las NP modificadas también mostraron una baja toxicidad para las líneas celulares, lo que resultó en una reducción notable de la supervivencia en las células MDA-MB-453 y la proliferación celular exponiéndolas a la hipertermia [41] . En comparación con otros métodos terapéuticos, este método ha aumentado la especificidad, en consecuencia, también puede proporcionar un tratamiento más eficaz. Además, varias características como alta estabilidad, tamaño ultrapequeño y resistencia a la agregación lo hacen más apropiado para futuros estudios in vivo.
Las nanopartículas guiadas magnéticamente son candidatas prometedoras en sistemas de administración de fármacos dirigidos. Para transportar nanopartículas guiadas magnéticamente o cargadas con fármacos a un área específica, se necesita un campo magnético externo constante [42] . Las nanopartículas guiadas magnéticamente son una de las mejores opciones que han adquirido una atención creciente por sus aplicaciones en la terapia del cáncer debido a su excelente estabilidad, buena biodegradabilidad, baja toxicidad y superparamagnetismo [43] . [44] . El sistema de administración de fármacos guiado magnéticamente se simplifica principalmente con el desarrollo de NP multifuncionales mediante la encapsulación de SPION y los agentes quimioterapéuticos dentro de los sistemas poliméricos deseados. Estas NP multifuncionales pueden administrar los agentes de manera dirigida dentro de los tumores. Hasta la fecha, los estudios informados sobre las MNP multifuncionales no han investigado completamente sus propiedades fisicoquímicas, incluida la citotoxicidad, la solubilidad, las propiedades magnéticas , etc. Kandasamy et al. [45] explicaron una nueva NP polimérica magnética multifuncional (MF-MPN) basada en ferrofluidos mediante la encapsulación individual de SPION hidrófobas recubiertas de oleilamina en las NP de poli(ácido láctico- co -glicólico) (PLGA), así como dos fármacos, curcumina (Cur) o verapamilo (Ver). Investigaron las propiedades magnéticas, la dispersabilidad, la biocompatibilidad y la eficacia de calentamiento de las MF-MPN seleccionadas. Finalmente, la eficiencia terapéutica de las MF-MPN se validó en el tratamiento del cáncer de hígado HepG2 a través de dos mecanismos diferentes, termoterapia mediante el uso de SPION y quimioterapia mediante Cur o Ver. Todos los resultados revelaron que los fármacos duales y las nanopartículas de PLGA con SPION mejoraron la eficiencia terapéutica en las células tumorales HepG2 a través del tratamiento integrado (quimioterapia y termoterapia) en comparación con el tratamiento individual. Por lo tanto, los ferrofluidos basados en MF-MPN (NP de PLGA con SPION y fármacos duales cargados conjuntamente) mostraron posibles opciones terapéuticas para la terapia multimodal in vitro del cáncer. También se ha demostrado que la encapsulación de PLGA podría mejorar la estabilidad de las SPION sin alterar ni afectar la potencia fototérmica, lo que puede minimizar la toxicidad y maximizar la eficiencia del tratamiento de la formulación [46] . [47] .
La terapia de hipertermia magnética contra el cáncer es otra opción de tratamiento convencional como la quimioterapia y la radioterapia. [48] . Curiosamente, tiene capacidad de focalización y baja toxicidad sistémica. Sin embargo, este enfoque tiene problemas importantes en la traducción clínica, como la susceptibilidad a la aglomeración de los agentes de calentamiento nano en medios acuosos, la generación y disipación de calor descontrolada en la región objetivo y la eliminación evitada por los sistemas reticuloendoteliales. En este sentido, SPION como un potencial agente de calentamiento nano dirigido estabilizado por una conformación micelar se fabricó para nuevas aplicaciones terapéuticas. Se cubrió con una capa delgada de policaprolactona (PCL) para obtener mayor termosensibilidad y citocompatibilidad. Con base en los hallazgos in vitro, la viabilidad de las células tumorales del hígado humano en la mayor concentración de SPION (100 μg/mL) disminuyó considerablemente a 40,1 ± 0,9% en el rango de temperatura de hipertermia segura. Este rango se obtuvo con los efectos de calentamiento de los SPION recubiertos con polímero en la existencia de un campo magnético alterno (AMF), lo que representa la aparición de citotoxicidad activa o desactivada de los SPION recubiertos con polímero mientras se exponen al AMF [49] . Las ventajas del SPION recubierto con PCL incluyen estabilidad estructural, mejor dispersividad, citocompatibilidad y calentamiento controlado en condiciones de hipertermia que lo presentan como una estrategia prometedora para la focalización activa de las células de carcinoma en el futuro [49] .
El proceso de síntesis de nanopartículas de oxihierro (ION) se ha evaluado en varios estudios que utilizan precursores de hierro (II). No obstante, los procedimientos de síntesis incluyen el uso de diferentes reactivos alcalinos o soluciones de bicarbonato , que no son deseables para fines biomédicos [50] , [51] . Se evaluaron los impactos de diferentes circunstancias oxidativas sobre las características magnéticas y fisicoquímicas y la citocompatibilidad de las SPION sintetizadas utilizando un único reactivo alcalino y precursor de hierro (II). Por primera vez, evaluaron la síntesis de SPION a través de un único precursor. Las condiciones de síntesis se optimizaron donde la relación N 2 :O 2 La relación de flujo juega un papel crítico en la búsqueda de usos prácticos para la terapia del cáncer. También se investigaron varias características de respuesta a la dosis de los SPION sintetizados en varias intensidades de campos magnéticos alternos (AMF). Luego, se evaluó la eficacia del calentamiento por inducción de los SPION óptimos bajo diferentes exposiciones a AMF. La viabilidad celular se redujo a 49 ± 0,3% por la actividad citotóxica de los SPION sintetizados en las células de cáncer de hígado humano en condiciones de hipertermia. Los hallazgos revelaron que dichos agentes de calentamiento nano magnéticos son candidatos efectivos para los objetivos de la terapia del cáncer.
Las nanopartículas conjugadas con anticuerpos podrían mantener la estructura química de los fármacos y administrarlos de forma controlada con baja toxicidad. Dado que algunas indicaciones del cáncer de mama tienen opciones terapéuticas restringidas, este campo ofrece esperanza para el tratamiento futuro de pacientes con cáncer de mama. Sin embargo, la reticulación de anticuerpos no es selectiva y causa el principal inconveniente de la falta de control sobre la orientación de los anticuerpos sobre la superficie de las nanopartículas [52] . En un estudio publicado recientemente, se evaluó la capacidad teranóstica de las SPION para diagnosticar y tratar el cáncer mediante el establecimiento de una única nanosonda integrada. Las SPION recubiertas de oleilamina (SPION-Ol) se sintetizaron y modificaron con trastuzumab (TZ) y protoporfirina (PP). La ablación fototérmica y los valores de relaxividad r2 se determinaron junto con la irradiación láser in vitro y la resonancia magnética. No hubo citotoxicidad después de la incubación de células MCF-7 bajo diferentes concentraciones de agentes teranósticos y SPION-Ol. Los resultados mostraron que el SPION-PP-TZ soluble en agua es un agente bimodal propicio para diagnosticar y tratar células de cáncer de mama positivas para el receptor del factor de crecimiento epidérmico humano (EGFR) 2 utilizando terapia fototérmica y un agente de contraste de resonancia magnética T2 [53] .
Se desarrolló una formulación de SPION con biopolímeros de poliaspartamida (PA) para el tratamiento de células tumorales mediante el método de hipertermia. La PA es un polímero biodegradable y biocompatible con una cadena principal de polisuccinimida que tiene un papel fundamental en la encapsulación de SPION. Los portadores de fármacos multifuncionales se pueden conjugar con otros grupos como la biotina para aumentar la capacidad de absorción de SPION por los receptores de las células tumorales. Los hallazgos revelaron que se obtiene un gran rendimiento biocompatible mediante la encapsulación de nanocalentadores SPION con biopolímero PA en términos de viabilidad celular y representó actividades útiles para matar el cáncer en pruebas de hipertermia tanto in vivo como in vitro. Los SPION encapsulados con PA exhibieron una buena capacidad de calentamiento mediante un experimento de hipertermia en condiciones ambientales, una mayor capacidad de absorción celular por parte del cáncer y una alta citotoxicidad contra las células cancerosas . Estos resultados abrirán un mayor potencial para el tratamiento del cáncer en el futuro. [54] .
Estudios previos han demostrado que se debe instalar una fracción bioactiva particular en SPION para tratar la metástasis ósea del cáncer de mama y dirigirse a los tejidos óseos. Se reveló que los péptidos ácidos de tamaño corto que comprenden secuencias repetitivas de ácido aspártico [55] se unen preferentemente a la hidroxiapatita , como el elemento principal en la composición orgánica del hueso. Pang et al. [56] informaron ejemplos de material basado en SPION para el tratamiento del cáncer. Utilizaron SPION dirigidos al hueso para inhibir la furina para aliviar la metástasis ósea del cáncer de mama. Tanto en la función de los osteoclastos como en la invasión de células tumorales, la proproteína convertasa furina juega un papel vital. El inhibidor de furina, un péptido que comprende una secuencia repetitiva de lisina-ácido aspártico-ácido glutámico, se administró a través de los SPION dirigidos al hueso para mejorar la circulación de NP dentro del torrente sanguíneo [56] . Además, un enlazador sensible a las metalopeptidasas de matriz (MMP) 2/9 se ha unido además al péptido inhibidor de la furina para mejorar la especificidad de las NP [57] , [58] . La MMP2/9 es un estímulo sensible a enzimas activado con fenotipos metastásicos/invasivos, que es un elemento crucial de la progresión tumoral. Simultáneamente, las MMP, particularmente la MMP9 , también son enzimas críticas en el proceso de resorción ósea. Por lo tanto, se estableció un sistema SPIONs multirresponsivo y multifuncional. Se dirige específicamente a los sitios metastásicos óseos, libera el péptido inhibidor de furina a través de la escisión inducida por MMP2/9 y genera contraste para la obtención de imágenes por resonancia magnética, lo que produce efectos antiosteoclásticos y anticancerígenos teranósticos (Fig. 1). Los datos in vivo e in vitro revelaron que dicho sistema puede prevenir la invasión del cáncer de mama y la resorción ósea osteoclástica, lo que da como resultado una osteólisis aliviada [56] .
Las nanopartículas conjugadas con péptidos han demostrado una mayor selectividad, una mayor afinidad de unión y una mayor eficacia terapéutica. Sin embargo, no se ha comprendido el comportamiento de las nanopartículas conjugadas con péptidos en condiciones fisiológicas, por ejemplo, en el espacio intracelular y en el torrente sanguíneo. Además, se ha descubierto la vulnerabilidad de los péptidos a la degradación enzimática. [59] , y la posible inmunogenicidad de las nanopartículas conjugadas con péptidos diseñados, y la pérdida de la función biológica de los péptidos que se combinaron covalentemente con las nanopartículas son algunos inconvenientes comunes para el uso in vivo y clínico [60] , [61] . De esta sección, se concluye que se aplicaron diferentes tipos de materiales basados en SPION para la terapia del cáncer. Una descripción general de los estudios informados que utilizaron materiales basados en SPION para la terapia del cáncer reveló que la combinación del enfoque SPION dirigido a la hipertermia con el anticuerpo anti-HER2 marcado con colorante fue el enfoque eficiente que logra de manera efectiva un método terapéutico local, específico del tumor y muy efectivo contra el cáncer de mama. Además, la instalación de una fracción bioactiva especial en SPION se puede utilizar de manera eficiente para dirigirse a la metástasis ósea del cáncer de mama debido a la dificultad de administrar medicamentos contra el cáncer al hueso. Sin embargo, la selectividad tisular inadecuada, la capacidad deficiente de carga de medicamentos y la biodistribución descontrolada de SPION son los principales inconvenientes que limitan su traducción clínica.
2.2. Materiales magnéticos a base de sílice para la terapia del cáncer
Los materiales a base de sílice son materiales biocompatibles con alta estabilidad química y física. [62] , [63] Recientemente, se han realizado varios estudios para producir materiales de sílice mesoporosos huecos para aumentar la eficiencia de la carga de fármacos [64] . Para la producción de esferas de sílice huecas con estructuras mesoporosas, se eliminaron las plantillas duras y blandas internas para crear la estructura hueca del nanocompuesto. [65] Sin embargo, los enfoques de síntesis actuales tienen limitaciones, como procedimientos que consumen mucho tiempo y configuraciones experimentales complicadas debido a la complejidad de la plantilla eliminada. [62] , [63] , [66] . Por lo tanto, es importante desarrollar una técnica sencilla para nanocompuestos huecos mesoporosos basados en sílice. [67] . Aquí se dan ejemplos recientes de materiales magnéticos a base de sílice para la terapia del cáncer.
Hsiao et al. construyeron una nueva plataforma teranóstica. [68] , que comprende un fármaco y un portador que se injertó ácido fólico-europio-gadolinio-sílice mesoporosa a través de un enlace disulfuro con L-cisteína (FA-EuGd-MSNs-SS-Cys). Puede proporcionar un instrumento terapéutico y de diagnóstico todo en uno con varias funcionalidades significativas, como rastreo, obtención de imágenes y administración de fármacos terapéuticos. Para crear el portador (EuGd-MSNs), se doparon europio (Eu 3+ ) y gadolinio (Gd 3+ ) en MSN y la conjugación de Cys en la superficie de EuGd-MSNs se realiza a través de un enlace disulfuro. [69] . Por lo tanto, se permite una penetración simple en la célula mientras se libera de forma controlada la terapia farmacológica . Además, la focalización de FA se obtuvo de manera más eficiente con especificidad y selectividad de fagocitosis. Los hallazgos revelaron que los FA-EuGd-MSNs-SS-Cys teranósticos multifuncionales pueden ser nanoplataformas efectivas para el tratamiento del cáncer guiado por imágenes y agentes terapéuticos simultáneos. La evaluación de la captación celular indicó que más células cancerosas son atrapadas por FA-EuGd-MSN en comparación con EuGd-MSN. Los materiales celulares revelaron que Eu 3+ emitió la fluorescencia roja intensa, una cantidad considerable de FA-EuGd-MSNs es tragada con las células Hela. Además, la sensibilidad a la fotoluminiscencia se mejora por la funcionalidad paramagnética del Gd 3+ A través de la resonancia magnética, la Cys se mostró como un reactivo anticancerígeno en una evaluación de citotoxicidad de FA-EuGd-MSNs-SS-Cys mediante un ensayo de bromuro de 2,5-difenil-2H-tetrazolio (MTT). También se revelaron excelentes características de EuGd-MSN, como la inexistencia de citotoxicidad, la estabilidad y una biocompatibilidad decente al cultivarse con células L929 normales. [68] . Ventajosamente, este enfoque puede funcionar como una nanoplataforma útil para un agente terapéutico simultáneo y un tratamiento guiado por imágenes para el cáncer. El diagnóstico y el tratamiento simultáneos en esta investigación son un beneficio importante con respecto a estudios anteriores.
La terapia de hipertermia basada en MNP tiene una variedad de beneficios en comparación con la terapia de hipertermia convencional, incluida la administración dirigida que resulta en un tratamiento más selectivo y efectivo, hipertermia localizada, cruce eficiente de la barrera hematoencefálica (BHE), reducción de la dosis efectiva necesaria de medicamentos quimioterapéuticos tóxicos, etc. [70] , [71] , [72] . En este sentido, se estableció un magnético con potenciales propiedades terapéuticas de quimio-hipertermia en términos de nanopartículas de sílice mesoporosas magnéticas recubiertas de copolímero termorresponsivas (MMSN) con poli(N-isopropil acrilamida- co- ácido metacrílico) (P(NIPAM- co -MAA)). La carga del fármaco anticanceroso modelo, clorhidrato de doxorrubicina (DOX.HCl), se realizó sobre MMSN@P(NIPAM- co -MAA). El rendimiento de liberación del fármaco sensible a la temperatura y al pH fue exhibido por DOX-MMSN@P(NIPAM- co -MAA) y MMSN@P(NIPAM- co -MAA). La liberación de DOX se aceleró por un entorno de pH más bajo y una temperatura de hipertermia. Los resultados del cultivo celular revelaron hipertermia, lo que conduce a una mayor eficacia para matar células cancerosas. Por lo tanto, las MMSN@P(NIPAM- co -MAA) representan una plataforma auspiciosa para el tratamiento del cáncer.
En otro estudio, se utilizó un MnSiO 3 @Fe 3 O 4 biodegradable que responde al microambiente tumoral. Se proporcionaron nanoplataformas para el tratamiento combinatorio del cáncer orientado a la resonancia magnética de modo dual. Los fármacos contra el cáncer se cargaron de manera eficiente en las nanoplataformas en las que se encontraba Fe 3 O 4 Las nanopartículas bloquean los poros de las nanopartículas de MnSiO 3 , lo que reduce la fuga de fármaco en circunstancias fisiológicas normales. En condiciones de alta concentración de glutatión (GSH) o de acidez débil, las nanoplataformas se rompieron y dieron lugar a la formación de Fe 3 O 4 Separación de NPs y liberación rápida de Mn 2+ iones y fármacos. Además, la superficie específica de las partículas magnéticas se puede mejorar mediante el Fe 3 O 4 exfoliado. Los nanocristales mejoran la actividad catalítica de la reacción de tipo Fenton en las células cancerosas. Por lo tanto, se genera más OH que mejora la apoptosis de las células HeLa. Según las pruebas in vitro e in vivo, se obtuvo una mejora notable en el contraste de la resonancia magnética de modo dual y la actividad anticancerígena de la nanoplataforma producida junto con una menor toxicidad sistémica. Además, el manganeso paramagnético (Mn 2+ ) podría desempeñar un papel en la reducción de la perturbación y la T 1 y tiempos de relajación T2 al mismo tiempo. Una nanoplataforma multifuncional de este tipo podría reducir eficazmente los efectos adversos del fármaco y podría ser útil para el control en tiempo real de la liberación del fármaco. Por lo tanto, puede ser una opción auspiciosa para la terapia sinérgica contra el cáncer y la resonancia magnética sensible al pH en usos clínicos [73] .
Para el tratamiento eficaz de defectos óseos de origen tumoral, todavía es un gran desafío diseñar y construir biomateriales multifuncionales. Tanto el quitosano (CS) como el biovidrio (BG) se han utilizado ampliamente en la reparación ósea debido a su excelente osteoconductividad, biodegradabilidad adecuada y buena biocompatibilidad. SrFe 12 O 19 (ferritas hexagonales de estroncio) como nanopartículas de nanopartículas (MNP) se modificó con un andamio poroso mesoporoso CS/BG y se ilustró la función antitumoral y la regeneración ósea. Se descubrió que la diferenciación osteogénica de células madre y la regeneración de hueso nuevo fueron promovidas considerablemente por nanopartículas magnéticas SrFe 12 O 19 en un andamio poroso de biovidrio (BG)/CS mesoporoso modificado (MBCS) a través de la vía BMP-2/Smad/Runx2 activada. Además, presentó agentes fototérmicos perfectos para matar células cancerosas residuales a través del tratamiento fototérmico NIR. Al irradiar láser de infrarrojo cercano (NIR), la apoptosis y la ablación tumoral se desencadenaron por las temperaturas elevadas de los tumores cocultivados con MBCS. En comparación con el grupo de andamio puro, el grupo MBCS/NIR mostró una excelente eficacia antitumoral contra la ablación por hipertermia del osteosarcoma . Ventajosamente, el MBCS multifuncional con funciones superiores de terapia fototérmica y regeneración ósea se puede utilizar eficazmente para tratar defectos óseos de origen tumoral [74] .
Con el progreso actual en la síntesis de nanotransportadores , se permite utilizar sistemas de administración dual de fármacos para encapsular dos fármacos y mejorar los impactos del tratamiento. En este sentido, las nanopartículas de Fe3O4 @ SiO2 @ácido tánico se utilizaron como un sistema de administración de fármacos sensible al pH para la administración simultánea de fármacos anticancerígenos de metotrexato (MTX) y DOX. Se realizaron estudios sobre la liberación de fármacos in vitro y el rendimiento de carga. Los nanotransportadores de MTX y DOX cargados exhibieron una liberación de fármacos controlada por el pH de un modo sostenido. Según el estudio de citotoxicidad del nanotransportador en blanco frente a las líneas celulares MCF-7, posee un futuro citocompatible. Sin embargo, la administración conjunta de DOX con MTX tuvo una citotoxicidad considerable para las líneas celulares MCF-7 como resultado de la formación de esqueletos pseudopeptídicos en el nanotransportador. Se demostró una fuga mínima de fármaco mediante el rendimiento de liberación de fármaco in vitro a pH 7,4 desde el Fe3O4 @ SiO2 @Tann. Esto reduce los impactos adversos en los tejidos normales. Por lo tanto, la liberación del fármaco es considerablemente mayor a pH 5, lo que mejora la citotoxicidad para los tejidos tumorales. Además, la prueba MTT reveló que el nanotransportador cargado con MTX-DOX poseía una mayor citotoxicidad contra las células MCF-7 en comparación con los fármacos libres. Los hallazgos revelaron que el Fe3O4 @ SiO2 @ Tann podría usarse como un posible sistema de administración de fármacos dirigido a los tejidos cancerosos. Además, se encontró potencial para el tratamiento contra el cáncer mediante las MNP de doble núcleo-capa sensibles al pH cargadas con fármaco anticanceroso preparado [75] . Las ventajas de este enfoque incluyen biocompatibilidad, estabilidad térmica , rica variedad y fácil control de la morfología, la estructura y el tamaño. Además, el uso simultáneo de dos fármacos puede mejorar en gran medida su efecto terapéutico.
En la actualidad, el método de fotoluminiscencia bimodal-MRI ha suscitado un gran interés debido a su mayor potencial en las prácticas clínicas y las investigaciones biomédicas. Una nueva nanosonda bimodal dirigida a tumores, FA-Gd-Tb@SiO 2 La nanosonda creada por Song et al. se creó mediante la unión covalente de un complejo luminiscente Tb 3+ , N, N, N, N-(4 -fenil-2,2:6,2 -terpiridina-6,6 -diil) bis (metilennitrilo) tetraacetato-Tb) en la estructura de nanopartículas de sílice , junto con su unión superficial de una molécula dirigida al tumor (ácido fólico, FA) y un agente de contraste de RM gadoteridol (Gd-DO 3 A) ( Fig. 1 ). La nanosonda creada muestra un alto r 1 y r 2 relajabilidades, unión dirigida al tumor y luminiscencia más fuerte y duradera. Basándose en imágenes de luminiscencia controlada por tiempo (TGL) celular in vitro, la nanosonda FA-Gd-Tb@SiO 2 se puede identificar y acumular en células tumorales que sobreexpresan el receptor FA . Además, la evaluación in vivo indicó que la nanosonda preparada tal como está puede mejorar de manera eficiente la intensidad de TGL y el contraste de RM ponderado en T 1 en el tejido canceroso. Por lo tanto, contribuye al rastreo y detección precisos de células tumorales, y a la identificación y tratamiento de tumores clínicamente. Ventajosamente, este estudio sugiere un nuevo método para el diseño de un nanofármaco muy específico, multifuncional y de tamaño controlado con un efecto fototérmico sobresaliente y un excelente rendimiento sensible al pH en la liberación y carga del fármaco. [76] .

- Descargar: Descargar imagen en alta resolución (122 KB)
- Descargar: Descargar imagen en tamaño completo
Figura 1 . El proceso de síntesis de la nanosonda de imágenes TGL/MR bimodales y su uso para rastrear células tumorales en el microambiente portador de tumores. (Reimpreso de la publicación Ref. [76] , Copyright (2021), con permiso de Elsevier (código de licencia; 5157770388261).
Se informó de una investigación interesante sobre una combinación de tratamiento fototérmico y de quimioterapia con Fe3O4 @ SiO2 cargado con DOX . Sistema de nanofármacos. Utilizando una técnica solvotermal sencilla, se preparó Fe3O4 MNP para controlar la relación de los reactivos para la obtención de Fe 3 O 4 magnético Partículas con un tamaño modificable (20∼400 nm). La carga de DOX en las partículas compuestas de Fe3O4 @ SiO2 sensibles al pH y de liberación sencilla se produjo en un entorno ácido. Esto es vital para la liberación específica del fármaco de las células tumorales, ya que las células tumorales poseían entornos internos ácidos que reducían los efectos secundarios tóxicos en las células normales. Mediante la irradiación con luz NIR (808 nm), se indujo la terapia fototérmica por el efecto fototérmico creado por Fe3O4 @ SiO2 @DOX al tiempo que se mejoraba la liberación del fármaco. Se evaluó la captación celular y la citotoxicidad de los nanofármacos Fe3O4 @ SiO2 @ DOX en células tumorales de pulmón A549. Casi el 82,8 % de las células de cáncer de pulmón A549 se pudieron eliminar mediante el tratamiento con Fe3O4 @ SiO2 @ DOX que contenía solo 10 μg/ml de DOX. Además, el 81,3% de las células de carcinoma de pulmón A549 murieron durante la incubación con Fe3O4 @ SiO2 @ DOX que comprende solo 0,5 μg/mL de DOX y 15 min de irradiación NIR, lo que propone un efecto quimio/fototérmico sinérgico excepcional en el tratamiento del cáncer. [77] .
Recientemente, se diseñó y estableció una técnica sencilla para construir esferas de sílice mesoporosas huecas de IONP (IONP-HMS) a través del enfoque de microemulsión de aceite en agua. Este sistema de administración de fármacos tiene muchas ventajas, incluida la generación simple a gran escala, el tamaño de poro uniforme ajustable, el área de superficie alta y los grandes volúmenes de poro . En este estudio, las esferas de IONP encapsuladas con bromuro de cetiltrimetilamonio (CTAB) se utilizaron como plantilla para construir capas de sílice mesoporosas. En la liberación y carga de DOX in vitro, los IONP-HMS se utilizaron como nanotransportador. Además, se realizó un análisis sobre la eficacia de los IONP-HMS cargados con DOX para el tratamiento del cáncer y su biocompatibilidad a través de exámenes de citotoxicidad celular. Los hallazgos revelaron que los IONP-HMS poseían una alta eficiencia de carga de fármacos que permite la liberación de DOX desencadenada por el pH in vitro. Además, los IONP-HMS presentaron una biocompatibilidad excepcional y aumentaron el efecto terapéutico del DOX en las células HeLa [67] .
2.3. Materiales de oro magnéticos para la terapia del cáncer
Las nanopartículas plasmónicas como el oro se utilizan para los fármacos de liberación controlada como resultado de su alta conversión de energía fotoeléctrica en calor. [78] Esto puede activar la liberación del fármaco precargado. [79] . Para la terapia contra el cáncer, los nanocompuestos multifuncionales con interacciones de interfaz y estructuras controladas son portadores atractivos. [80] . Nanocompuestos activados magnéticamente y ópticamente, como nanopartículas con forma de mancuerna, que comprenden dos superficies químicas que son apropiadas para la administración de fármacos sensibles al pH y la focalización sincronizada de células. [81] , [82] Sin embargo, un sistema sensible al pH podría no funcionar bien en cambios ambientales complejos cuando interfiere con otros factores en el procedimiento de liberación. A continuación, revisaremos los estudios publicados recientemente sobre materiales de oro magnético para la terapia del cáncer.
En la actualidad, Jian et al. sintetizaron nanopartículas de oro con forma de mancuerna cargadas positivamente (NP de Au-Fe 3 O 4 ) para la administración dirigida de aptámeros de VEGF a células tumorales de ovario . La interacción dominante entre los aptámeros de ADN y la administración dirigida de VEGF a la superficie de Au-Fe 3 O 4 es la absorción electrostática. Se utilizó microscopía confocal para observar el reconocimiento dirigido de células tumorales de ovario a través de los aptámeros de Au-Fe 3 O 4 funcionalizados. NP (Apt-Au- Fe3O4 ) NP). Se encontró que Apt-Au-Fe 3 O 4 Las nanopartículas se unen específicamente a las células tumorales de ovario SKOV-3, lo que da como resultado una marcada liberación intracelular de aptámeros sobre la radiación de luz resonante de plasmón. Por lo tanto, la inhibición in vitro se mejora frente a la proliferación de células tumorales. Los hallazgos revelaron el alto potencial de las nanopartículas de Apt-Au- Fe3O4 como portadores de hipertermia del cáncer dirigidos a través del control remoto con alta resolución temporal/espacial. Las características y aptitudes únicas de los aptámeros incluyen una gran afinidad de unión, un tamaño pequeño, una alta especificidad, no inmunogenicidad y facilidad de modificación en comparación con los anticuerpos monoclonales tradicionales. Los principales inconvenientes de los aptámeros para usos clínicos incluyen una baja selectividad que los restringe en la orientación celular y la liberación exacta de aptámeros. Para aplicaciones terapéuticas eficientes y de diagnóstico altamente sensibles, las nanopartículas de Au-Fe3O4 con forma de mancuerna son adecuadas . Las nanopartículas tendrán un gran potencial como nanoportadores [84] .
La eficacia de la terapia fototérmica en el tratamiento del cáncer ha sido demostrada en estudios anteriores. Sin embargo, no es probable asegurar la eliminación selectiva y completa de todas las células cancerosas, ya que numerosas células pueden escapar y provocar la recurrencia del cáncer [85] . Por lo tanto, la combinación de dos o más enfoques terapéuticos puede superar las graves restricciones que se encuentran con el uso por separado de cada tratamiento. [86] , [87] , [88] La quimioterapia/terapia fototérmica dirigida adyuvante es una de las modalidades oncológicas integradas. Podría aplicarse para administrar medicamentos y aumentar la temperatura local en el sitio del tumor sin influir en los tejidos adyacentes normales. [89] , [90] , [91] , [92] Este tratamiento integrado podría obtenerse utilizando un nanohíbrido todo en uno. Puede activarse utilizando rayos láser que sirvan como estímulo externo para inducir fototérmicamente y actuar como nanotransportadores de fármacos [93] . Además, los efectos térmicos pueden incrementar las respuestas celulares a los fármacos quimioterapéuticos. Por lo tanto, esta terapia se puede administrar en dosis más bajas. [94] , [95] Recientemente, se han dedicado más esfuerzos al diseño de potentes nanopartículas teranósticas y a la integración de agentes diagnósticos y terapéuticos para una terapia eficaz contra el cáncer. Elbialy et al. establecieron nanopartículas de oro magnéticas multifuncionales (MGNP) para la administración selectiva del fármaco al sitio del tumor en un modo de liberación controlada utilizando la orientación magnética; estimulan la terapia fototérmica con la generación de calor mediante la absorción láser cercana al NIR y sirven como agentes de contraste para la MRI. Las MGNP producidas se caracterizaron mediante varios métodos físicos. Luego, se conjugaron con PEG y DOX para formar conjugados MGNP-DOX. La mayor eficiencia de MGNP-DOX para el tratamiento quimio/fototérmico integrado se encontró tanto in vivo como in vitro. Los estudios inmunohistoquímicos y el examen histopatológico confirmaron la eficiencia de MGNP-DOX como material teranóstico. Además, MGNP-DOX representó un potencial decente como agentes de contraste de MRI para terapias sinérgicas quimio/fototérmicas dirigidas. Este trabajo mejora la comprensión de esta política terapéutica, optimizando y utilizando así las MGNP como sistemas multifuncionales de administración de fármacos [96] . Además, en otro estudio, se desarrolló un sistema multifuncional de administración de fármacos basado en glóbulos rojos (RBC) para la administración de fármacos y la terapia combinada guiada por imágenes del cáncer. Las MNP recubiertas con cloro e6 (Ce6) se adhirieron a la membrana de los glóbulos rojos y luego se cargó DOX dentro de los glóbulos rojos. Los datos de imágenes ex vivo e in vivo mostraron la anidación tumoral inducida por el campo magnético muy eficiente de esos glóbulos rojos después de la inyección intravenosa en ratones [97] .
El cáncer de mama triple negativo (CMTN) es un tipo de cáncer muy agresivo, que difícilmente se cura con la quimioterapia convencional. La razón principal es la resistencia a los fármacos del CMTN y la falta de capacidad eficaz de los fármacos actuales para actuar sobre el tumor. [98] . Por lo tanto, se requiere urgentemente desarrollar nuevos enfoques para una terapia de TNBC precisa y de alta eficiencia.
Se fabricó una nanoheteroestructura de oro magnética multifuncional con fotosensibilizador Ce 6 carga (MF-MGN@Ce 6 ) para el tratamiento fotodinámico y fototérmico sinérgico (PTT/PDT) de TNBC ( Fig. 2 ). El péptido molecular dirigido a las mitocondrias y dirigido a la membrana celular de cRGD de TPP se funcionalizó sobre el nanosistema para obtener MF-MGN@Ce 6 @RT. Las evaluaciones in vitro e in vivo revelaron una excelente biocompatibilidad de MF-MGN@Ce 6 @RT. Los hallazgos revelaron que el diseño de doble focalización de cRGD/TPP garantiza la administración precisa de MF-MGN@Ce 6 @RT a los tumores TNBC. También mejoró considerablemente los efectos fototerapéuticos del nanosistema. La heteroestructura de MF-MGN@Ce 6 @RT que integra ambos componentes de oro y óxido de hierro , MF-MGN@Ce 6 @RT se reveló como un factor de contraste superior para la obtención de imágenes trimodales de tumores in vivo por MRI/CT/PA. Por lo tanto, conduce a una supresión completa del crecimiento tumoral. Sus resultados presentan nuevas nanoplataformas para la identificación y el tratamiento de alta eficiencia y precisión de los TNBC. [99] .

- Descargar: Descargar imagen en alta resolución (208 KB)
- Descargar: Descargar imagen en tamaño completo
Figura 2 . Diagramas esquemáticos para la fabricación de MF-MGNs@Ce 6 @RT y su aplicación en diagnóstico multimodal, fototerapia combinada, tratamiento fototérmico y fotodinámico. (Reimpreso de la publicación ref. [99] , Copyright (2021), con permiso de Elsevier (código de licencia; 5157770618319).
2.4. Quitosano magnético para la terapia del cáncer
Recientemente, la aplicación de polisacáridos ha atraído mucha atención en la nanomedicina [100] , [101] . En particular, el quitosano (CS) como polisacárido natural se ha utilizado en algunos usos médicos. [102] , de modo que las terapias contra el cáncer con CS como portador de administración del fármaco se han descrito ampliamente como un método prometedor y beneficioso con gran flexibilidad, biocompatibilidad y eficacia. [103] , [104] Con el avance de los estudios basados en polisacáridos, se han logrado grandes avances en el campo de la administración dirigida de fármacos en los ensayos clínicos, así como en la investigación [105] , [106] . Aquí, discutiremos el avance reciente del material basado en CS magnético para la terapia del cáncer.
Shanavas et al. evaluaron MNP híbridos con 'núcleo' de PLGA y superficie modificada con 'cubierta' de conjugado de folato-CS como contraste de MRI y agentes terapéuticos anticancerígenos simultáneos. Los conjugados de folato-CS se prepararon utilizando química de reticulación de carbodiimida para cubrir SPION bien empaquetados con una capa adicional de docetaxel cargado con PLGA. Para encapsular mejor los cristales dentro de la matriz de polímero , se fijó una proporción óptima de SPION a PLGA en 1:10 para proporcionar una característica de magnetización considerable al nanocompuesto para su uso como agente de contraste de RM. La liberación de fármacos contra el cáncer del polímero CS se lleva a cabo por estímulos externos e internos ( Fig. 3 ). En este estudio, a pH ácido, el recubrimiento de CS sensible al pH desencadenó la liberación del fármaco de las NP. La administración de SPION dirigida al receptor y docetaxel fue proporcionada por NP híbridas biocompatibles para el tratamiento contra el cáncer y la resonancia magnética respectivamente, como se examinó en células cancerosas tanto positivas como negativas al receptor de folato. Se demostró una mejor captación celular mediante la orientación al receptor de ácido fólico , por lo tanto, la citotoxicidad aumentó contra las células KB que sobreexpresan el receptor de folato. La captación celular mejorada aumentó directamente la eficacia anticancerígena y disminuyó la T 2 tiempo de relajación del entorno de las células tumorales. Por lo tanto, se obtuvieron imágenes de contraste de resonancia magnética ponderadas en T2 más oscuras en comparación con las células de control. Se descubrió el inmenso potencial de este agente teranóstico híbrido de núcleo/capa biocompatible dirigido al receptor para la obtención de imágenes por RM y el tratamiento simultáneos del cáncer. [107] .

- Descargar: Descargar imagen en alta resolución (164 KB)
- Descargar: Descargar imagen en tamaño completo
Figura 3 . Liberación de fármacos contra el cáncer a partir de nanotransportadores de quitosano en respuesta a estímulos internos/externos. (Reimpreso de la publicación ref. [107] , Copyright (2021), con autorización de Elsevier (código 5157790417598).
La actividad antiproliferativa y antiangiogénica de la artemisinina se encontró como un agente antipalúdico natural en las células cancerosas con una toxicidad muy baja para las células normales. Tiene una aplicación limitada en el tratamiento del cáncer debido a su alta solubilidad en lípidos, ya que es difícil lograr una concentración terapéutica sin toxicidad para las células normales [108] . Recientemente, el polímero natural CS se utilizó como agente de formulación para cargar artemisinina en MNP. Las NP de tamaño uniforme se hacen mediante la optimización de las circunstancias de formulación. Las partículas representaron una buena capacidad de carga del fármaco y una encapsulación eficaz del fármaco con características magnéticas adecuadas. La eficiencia de la encapsulación del fármaco se encontró en 55% - 62,5% junto con la capacidad de carga del fármaco de 20% - 25%. Después de 48 h, la artemisinina se liberó (casi 62% - 78%) de las MNP de artemisinina. En cuanto a los campos magnéticos externos fisiológicamente aceptables, se demostró una acumulación mejorada de nanopartículas mediante MNP de artemisinina conjugadas con isotiocianato de fluoresceína (FITC) dentro de los tejidos tumorales de mama 4T1 del modelo de ratones BALB/c [109] . Para una mayor carga de fármaco, una liberación más específica del fármaco y una mayor actividad anticancerígena, se aplicó la siguiente estrategia.
Adimoolam et al. establecieron una formulación que incluye DOX conjugado a MNP a través de un enlace imino sensible al pH con glutaraldehído como reticulante. Utilizando una técnica de hidrólisis simple, se realizó la síntesis de varias cantidades de MNP funcionalizadas con CS in situ a temperatura ambiente. Para las investigaciones de liberación del fármaco a pH de los lisosomas y endosomas, se utilizaron las MNP conjugadas con DOX recién sintetizadas en varias soluciones tampón de pH. Las pruebas de viabilidad celular en las líneas celulares SKOV3 y MCF7 revelaron que la DOX conjugada con MNP representó un impacto terapéutico mejorado en comparación con concentraciones equivalentes del fármaco libre. Otra ventaja de las MNP es su menor toxicidad para las células normales como resultado de su capacidad de focalización [110] .
La interacción reticulada química entre el diisotiocianato de tereftaloilo sintético como reticulante y las cadenas poliméricas CS fue realizada por Eivazzadeh-Keihan et al. [111] . Se fabricó un hidrogel de CS reticulado tridimensional (3D) con alta estabilidad, porosidad y homogeneidad y luego se lo utilizó como un nuevo sustrato para generar un nuevo nanocompuesto de CS reticulado con tereftaloil tiourea magnético. El rendimiento del nanocompuesto magnético diseñado se evaluó mediante el proceso de hipertermia de fluido magnético. La tasa de absorción específica (66,92 w/g) se definió mediante la alternancia del campo magnético (AMF) con un valor de magnetización de 78,43 emu/g.
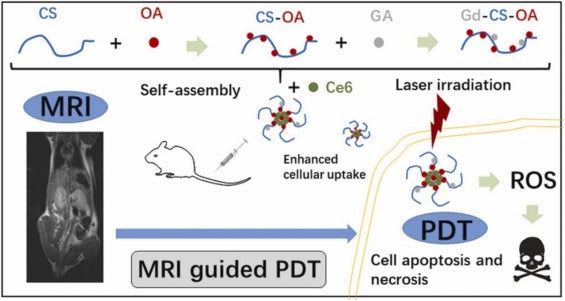
Recientemente, Zhao et al. produjeron con éxito un polímero derivado de CS mediante la conjugación química de CS, ácido gadopentético (GA) y ácido octadecanoico (OA) ( Fig. 4 ). El Gd-CS-OA/Ce 6 obtenido Representaba una capacidad de resonancia magnética mejorada con una biocompatibilidad y estabilidad deseables. Además, el Gd-CS-OA/Ce 6 Mejoró el Ce 6 captación en 4 T 1 células tanto en pruebas in vitro como in vivo. Gd-CS-OA/Ce 6 Puede realizar PDT guiada por resonancia magnética tanto en modelos con tumores como en 4 T 1 células que presentan ventajas anticancerígenas mejoradas en comparación con Ce 6 libre. Por lo tanto, Gd-CS-OA/Ce 6 Fue indicado como un DDS teranóstico capaz para el tratamiento eficiente del cáncer. [112] .

- Descargar: Descargar imagen en alta resolución (176 KB)
- Descargar: Descargar imagen en tamaño completo
Figura 4 . La figura muestra la preparación, PDT guiada por resonancia magnética de Gd-CS-OA/Ce 6 y carga de fármaco. (Reimpreso de la publicación Ref. [112] , Copyright (2021), con permiso de Elsevier (código de licencia;5157780028007).
2.5. Material magnético a base de metal para la terapia del cáncer
Las nanopartículas basadas en metales tienen diversos tamaños y formas y se han estudiado por su papel en la detección y administración dirigida de fármacos. [113] , [114] . Las características únicas de las nanopartículas metálicas , por ejemplo, la alta relación área superficial a volumen, la síntesis química fácil, las amplias características ópticas y la fácil funcionalización de la superficie son prometedoras en el campo biomédico para la terapia del cáncer [115] , [116] , [117] Estas NP también podrían funcionalizarse de forma sencilla con numerosas fracciones, por ejemplo, anticuerpos, péptidos, ADN o ARN para dirigirse particularmente a varias células. [118] y con polímeros biocompatibles para ampliar su circulación in vivo para usos de administración de genes y fármacos. [119] , [120] Además, podrían convertir eficazmente la radiofrecuencia o la luz en calor, lo que permitiría la ablación térmica de tumores. [121] , [122] .
La escisión quirúrgica del tumor es un método terapéutico convencional contra las metástasis óseas inducidas por el cáncer de mama; sin embargo, puede causar defectos óseos y recurrencia del cáncer. Para superar estos problemas, Zhao et al. fabricaron el GdPO 4 /CS/Fe 3 O 4 multifuncional. andamios donde las nanobarras de GdPO4 hidratadas se organizaron en las matrices de CS bioactivas magnéticas para la terapia fototérmica del cáncer y la regeneración ósea. El Fe3O4 Las nanopartículas en los andamios se pueden utilizar como agentes fototérmicos para la oncoterapia, y las nanobarras de GdPO4 · H2O muy bien dispuestas pueden promover las capacidades de osteogénesis y angiogénesis. Bajo la irradiación del láser NIR, las temperaturas locales que rodean el GdPO4 / CS / Fe3O4 Se mejoraron los andamios para promover la apoptosis de las células tumorales y evitar la recurrencia del cáncer. Los nuevos vasos sanguíneos proporcionaron nutrientes y oxígeno para la osteogénesis. Además, el GdPO 4 Las nanobarras en los andamios estimularon la vía de señalización BMP-2/Smad/RUNX2 que ayudó a la proliferación celular, la diferenciación y la regeneración del tejido óseo. Por lo tanto, el nuevo GdPO 4 /CS/Fe 3 O 4 Los andamios con función de curación de defectos óseos y la terapia fototérmica de tumores pueden convertirse en una plataforma propicia para el tratamiento eficiente de las metástasis óseas del cáncer de mama. [123] .
Los conjugados de fotosensibilizadores y nanopartículas capaces de realizar terapia fotodinámica inducida por rayos X (X-PDT) son un foco de investigación debido a sus prometedores usos en la terapia del cáncer. Jain et al. desarrollaron el nanocompuesto magnético-luminiscente Gd 2.98 Ce 0.02 Al 5 O 12 @mSiO 2 @rosa de Bengala (GAG@mSiO 2 @RB) para ser utilizado como agente X-PDT. El nanocompuesto GAG@mSiO 2 @RB desarrollado exhibió una Transferencia de Energía de Resonancia de Fluorescencia (FRET) efectiva al cargarse con RB debido a la gran superposición espectral entre el RB y el GAG. Se encontró que, con subexposición a rayos X de baja energía, el nanocompuesto GAG@mSiO 2 @RB produjo 4 veces más oxígeno singlete . Se logró una PDT eficaz de células MDA-MB-231 incubadas con nanocompuesto GAG@mSiO2 @RB tras la irradiación con luz azul, en comparación con RB solo. El nanocompuesto GAG@ mSiO2 @RB generó ROS de manera eficiente tras la excitación con rayos X. Además, debido a la presencia de Gd en la red cristalina del granate , el sistema nanocompuesto sugerido indicó una naturaleza paramagnética, que puede superar los problemas de la penetración restringida de la luz para la teranóstica del cáncer. La biocompatibilidad, la no inmunogenicidad, la eficiencia óptima de fotoluminiscencia y las propiedades magnéticas sin efectos nocivos en ausencia de luz proponen al nanocompuesto GAG@mSiO2 @RB como un candidato atractivo para sus aplicaciones. Esta nueva nanoplataforma magnética-luminiscente es prometedora para usos futuros en el diagnóstico y tratamiento simultáneos de cánceres profundos. [124] .
Los sistemas de administración de fármacos (DDS) aumentan el potencial del fármaco en los tratamientos porque lo protegen de una degradación rápida. Se han aplicado MMSN no tóxicos para la liberación controlada de fármacos y su focalización. Las nanopartículas de Fe3O4@mSiO2 se modificaron con ácido fólico unido a polietilenimina (PEI-FA) para mejorar su solubilidad en agua y su especificidad para las células tumorales ( Fig. 5 ). Por lo tanto, el sistema transportador de disulfiram (DSF) selectivo para el cáncer (mMDPF) se fabricó con una relación superficie-volumen mejorada. La capacidad de carga del fármaco del mMDPF se calculó en un 4,35 % mediante HPLC y la mejor cinética de liberación del fármaco del mMDPF se detectó a pH 6,0 y 37 °C, que es el pH del endosoma. La citotoxicidad del mMDPF en las células MCF-7 se mejoró utilizando mMDPF con nitroprusiato de sodio o cobre. Descubrieron que el mMDPF se absorbía más utilizando células MCF-7 y su toxicidad en las células MCF-7 era mucho mayor que en las células no tumorígenas. Ventajosamente, la alta solubilidad y especificidad, la no toxicidad, la eliminación selectiva de células cancerosas, la focalización y la liberación controlable de fármacos se encuentran entre los beneficios que se pueden mencionar para este sistema de administración de fármacos [125] .

- Descargar: Descargar imagen en alta resolución (279 KB)
- Descargar: Descargar imagen en tamaño completo
Figura 5 . Diagrama esquemático de una terapia selectiva dirigida contra el cáncer con NP cargadas con DSF mesoporoso magnético. (Reimpreso de la publicación Ref. [125] , Coppyright (2021), con permiso de Elsevier (código de licencia; 5157780228470).
La detección temprana es crucial para el tratamiento eficaz del cáncer. Sin embargo, un único modo de resonancia magnética es difícil de satisfacer las altas necesidades de diagnóstico preciso debido a los defectos innatos. Jian-Hua et al. construyeron nanopartículas de ácido poliacrílico Fe3O4 @ MnO2 @ PAA ( Fe3O4 @ MnO2 @ PAA ) para la T1 /T2 sensible al pH . Terapia fototérmica guiada por resonancia magnética de doble modelo. El Fe 3 O 4 El núcleo proporcionó a las nanopartículas de Fe3O4 @ MnO2 @ PAA la capacidad de realización de agentes de contraste de resonancia magnética ponderados en T2 , y las nanocapas de MnO2 propusieron un gran potencial para la resonancia magnética ponderada en T1 sensible al pH . Este T1 / T2 sensible al pH La resonancia magnética de doble modelo mejoró la especificidad y la sensibilidad y también ofreció datos más completos para el diagnóstico del cáncer. Además, las nanopartículas de Fe3O4 @ MnO2 @ PAA mostraron un gran rendimiento fototérmico debido al potente rendimiento de absorción NIR, logrando el objetivo de matar células tumorales sin dañar las células normales. Por lo tanto, se reveló que este nanocompuesto puede ser un agente teranóstico sensible al pH esperanzador para ofrecer información precisa y detallada para la detección y el tratamiento del cáncer. [126] .
2.6. Materiales magnéticos a base de carbono para la terapia del cáncer
En los últimos años, los nanomateriales basados en carbono han atraído mucha atención debido a su capacidad de funcionar como plataforma para unir ligandos o fármacos [127] . Con frecuencia se aplican modelos simples en estudios sobre el cáncer, en los que los nanomateriales de carbono se conjugan con un ligando que es específico de un receptor sobreexpresado para la administración de fármacos y la obtención de imágenes en la terapia contra el cáncer. [128] , [129] Estos nanomateriales de carbono presentan características únicas para el vehículo de administración o la obtención de imágenes debido a sus altas cualidades de fluorescencia y su naturaleza no tóxica. [130] A continuación, analizamos estudios publicados recientemente sobre materiales basados en carbono magnético para la terapia del cáncer.
Recientemente, se evaluaron los impactos terapéuticos de la irradiación NIR en células A549 resistentes a DOX y se llevaron a cabo investigaciones in vivo equivalentes para evaluar el comportamiento de las sustancias sintetizadas sobre el tratamiento quimio/fototérmico dirigido (quimio-PTT). Se informó que las nanopartículas de Fe3O4 @carbon@DOX funcionalizadas con aptámeros (Apt- Fe3O4 @C@DOX) tienen un efecto sinérgico sobre el quimio-PTT del cáncer ( Fig. 6 ). Gracias a la excelente capacidad de focalización tumoral activa de las nanopartículas de Apt- Fe3O4 @C@DOX, se permitió el reconocimiento simultáneo de los tumores diana mediante imágenes por RM. Según un ensayo de citotoxicidad in vitro, el quimio-PTT integrado es más tóxico para las líneas celulares A549 en comparación con el PTT o el agente de quimioterapia solo. La terapia explicada redujo las tasas de crecimiento tumoral mientras existían cantidades incluso bajas de DOX. Esto probablemente se debe a la generación de calor intracelular inducida por el efecto fototérmico. Disminuye el metabolismo de DOX e incrementa la acumulación de DOX en las células tumorales. Estos resultados revelaron que la terapia de combinación de quimioterapia y PTT propuesta puede obtener una alta eficiencia terapéutica contra tumores basados en A549 con una biocompatibilidad sobresaliente [131] .

- Descargar: Descargar imagen en alta resolución (306 KB)
- Descargar: Descargar imagen en tamaño completo
Figura 6 . Ilustración esquemática de la preparación de nanopartículas de Apt- Fe3O4 @C@DOX y su internalización en células tumorales para el tratamiento de combinación quimiofototérmica. ( Reimpreso de la publicación Ref. [131] , Copyright (2021), con permiso de Elsevier (código de licencia; 5157780336267).
Aún es un desafío administrar a través de la BHE y dirigirse a tumores cerebrales como el glioblastoma [132] . Por lo tanto, se buscan intensamente nuevos enfoques terapéuticos y portadores de administración de fármacos. En este sentido, Wu et al. [131] cambiaron el concepto de partícula presentado anteriormente y crearon un ferrofluido acuoso sin surfactante. Comprendía SPIONs cubiertos con capas de carbono y mesocapas de silicato. La doble cubierta de SPIONs influyó en numerosas características biológicas y fisicoquímicas, como la eficacia para atacar el cáncer y la estabilidad coloidal. Las NPs redujeron la viabilidad de los tumores de osteosarcoma y glioblastoma en comparación con sus análogos primarios y no transformados. Se representó una mejor preferencia por las células cancerosas como resultado de una mayor tasa de captación de las células y una notable adherencia a la membrana de la célula tumoral. Las NPs generaron suficiente calor incluso en un campo magnético alterno ultrabajo para provocar la muerte del tumor. En los compartimentos basolaterales, se encontraron NPs. Además, la evaluación de LAMP1 reveló que las NP atravesaron la BHE transcelular y escaparon del lisosoma mientras se localizaban en los lóbulos ópticos de los cerebros larvarios del tercer estadio de Drosophila melanogaster . El paso no invasivo resultó en bajos impactos sistémicos adversos para los animales. Se deduce que dichos ferrofluidos nanoparticulados se adhieren a las células cancerosas y, por lo tanto, revelan una mayor toxicidad en estas células en comparación con las células primarias. Por lo tanto, tienen una mayor efectividad in vitro contra tumores sólidos y pueden atravesar la BHE en Drosophila. Estas partículas también son no tóxicas según los estudios en evolución sobre moscas cultivadas en medios infundidos con ferrofluidos [131] .
Ha habido un gran interés en las nuevas nanopartículas de núcleo-capa multifuncionales como resultado de sus abundantes grupos funcionales y propiedades superficiales fáciles de modificar. Recientemente, se sintetizaron nanopartículas de Ag@ Fe3O4 @C-PEG-FA con estructura regular, tamaño uniforme y mayores capacidades de carga de DOX. Ventajosamente, las nanopartículas de Ag@Fe3O4 @ C-PEG-FA/DOX sintetizadas tuvieron buenos impactos fototérmicos y mejoraron la liberación de DOX mediante la irradiación de luz de 808 nm. Además, las nanopartículas de Ag@ Fe3O4 @C-PEG-FA/DOX poseían biocompatibilidad, estabilidad, tratamiento sinérgico y focalización de células cancerosas excepcionales sin ningún efecto secundario tóxico en los animales tratados. El PEG de múltiples brazos en los bordes de las nanopartículas de Ag@ Fe3O4 @ C proporciona una capacidad superior para los materiales para cargar DOX. Como resultado de la capacidad superior de absorción del infrarrojo cercano (NIR) de la capa de carbono, se puede utilizar como fototérmico, Fe 3 O 4 Se empleó como reactivo para la resonancia magnética. Se incluyeron especificidades de imágenes multimodales para imágenes DOX FL e imágenes de RM mejoradas con T2 en el área del tumor y un impacto inhibidor decente en el crecimiento del tumor sinérgico al tratamiento quimio/fototérmico. No hubo efectos secundarios obvios ni toxicidad en los animales de control y tratados. Por lo tanto, las nanopartículas de Ag@ Fe3O4 @C-PEG-FA son nanoplataformas perfectas para la terapia quimio/fototérmica y la obtención de imágenes multimodelo. [133] .
2.7. Materiales modificados con PEG magnéticos para la terapia del cáncer
Los materiales basados en PEG, como un candidato prometedor para la terapia dirigida de varios tipos de cáncer, podrían autoensamblarse en NP en el medio acuoso y ofrecer una superficie oculta que podría disminuir el reconocimiento del sistema reticuloendotelial (RES) de las NP y puede extender el tiempo de circulación sanguínea. [134] En teoría, las nanopartículas anfipáticas ensambladas con PEG pueden no ser opsonizadas en absoluto y permanecer en la circulación sanguínea hasta que penetran en las vasculaturas permeables del tumor. [118] , mejorando así la posibilidad de obtener su sitio de acción. La incorporación de una pequeña parte de material anfifílico basado en PEG disminuye la captación y opsonización de RES, mejora la hidrofilicidad de la superficie y el tiempo de circulación de los liposomas , lo que contribuye a mejorar la concentración del fármaco en el derrame maligno [135] , [136] . Por lo tanto, los nanomateriales anfifílicos basados en PEG desempeñan un papel clave en las terapias de focalización pasiva. En este artículo, analizamos estudios publicados recientemente sobre materiales magnéticos modificados con PEG para la terapia del cáncer.
Se sintetizó un copolímero injertado con polisuccinimida (PSI) como precursor de polímero reticulado para la fabricación de MNP reticulados biodegradables y biocompatibles. Los MNP se cubrieron con el PSI anfifílico injertado con cadenas de PEG conjugadas con alquilo y folato. Sobre la capa interna de los NP, las unidades de succinimida se reticularon y se transformaron en una estructura biodegradable y biocompatible que comprende enlaces amida . Se utilizaron más para tolerar grupos amina libres en la superficie de los MNP reticulados (CMNP). Finalmente, los CMNP se conjugaron con el colorante fluorescente de infrarrojo cercano (NIR) Cy5.5 para su aplicación en usos específicos de resonancia magnética o imágenes ópticas dirigidos al cáncer. Los CMNP conjugados con folato y Cy5.5 resultantes tenían un diámetro de aproximadamente 45 nm, lo que representa una excelente idoneidad y un T 2 más alto. Coeficiente de relaxividad. Basándose en los estudios in vivo e in vitro, se demuestra la eficacia potencial de las CMNP-Cy5.5-fol como sondas de obtención de imágenes dobles para usos específicos de obtención de imágenes NIR/MR dirigidas al cáncer. Las ventajas de las CMNP incluyen biocompatibilidad, biodegradabilidad, excelente estabilidad estructural in vivo y multifuncionalidad, orientación específica al cáncer y modalidades de obtención de imágenes duales. [137] .
En la actualidad, los anticuerpos monoclonales se utilizan para el tratamiento de numerosas enfermedades, incluido el cáncer [138] . En lo que respecta a la administración de fármacos dirigida a tumores específicos, existen numerosos esfuerzos para crear nanopartículas conjugadas con anticuerpos que puedan mostrar un efecto terapéutico muy mejorado en diferentes tipos de cáncer. [139] . En general, tanto CD133 como CD44 se aceptan como marcadores de células madre de cáncer gástrico. En un estudio reciente, las células madre de cáncer gástrico fueron dirigidas a través de NP de PLGA-lecitina-PEG cargadas con ácido transretinoico conjugado con anticuerpos CD133 y CD44 (ATRA-PLPN) (Fig. 8). Sus efectos terapéuticos se examinaron contra las células madre de cáncer gástrico y los resultados demostraron la administración eficiente y especial de CD133/CD44 a células madre de cáncer gástrico CD44++ y CD44++ o CD133. Por lo tanto, los efectos inhibidores del crecimiento se potenciaron en las células madre de cáncer gástrico en comparación con NP dirigidas y no dirigidas individuales. El presente trabajo ha informado sobre la elevación de la administración de NP a dos grupos de células madre de cáncer gástrico a través de anticuerpos. Por lo general, el cáncer incluye grupos distintos de células madre cancerosas con muchos fenotipos. Por lo tanto, nuestras nanopartículas de doble orientación crean plataformas de administración de fármacos eficientes para dirigir numerosas poblaciones de células madre cancerosas al cáncer. La orientación eficaz y específica, la mayor biodistribución y la endocitosis mejorada de las nanopartículas en las células tumorales son algunos de los beneficios de esta plataforma de administración de fármacos. Sin embargo, debido al bajo número de células madre de cáncer gástrico en la masa tumoral, la obtención de imágenes ópticas de la orientación de CD44/CD133-ATRA-PLPN a las células madre de cáncer gástrico in vivo es difícil [140] .
Recientemente se presentaron microcápsulas compuestas de polímero Fe3O4 con un diámetro normal de 885,6 y 587 nm para la cirugía de ultrasonidos focalizados guiada por resonancia magnética (MRgFUS). [141] , [142] . Pueden mejorar la deposición de energía y la absorción de ondas ultrasónicas en el tejido objetivo, por lo tanto, se incrementan los impactos ablativos tumorales de MRgFUS. [141] . La creación de un PEGilado de orientación activa Fe 3 O 4 Se demostró la plataforma de nanopartículas. Se utilizó anti-EGFR para decorar las superficies de nanopartículas de Fe 3 O 4 pegiladas , para la administración guiada al cáncer de hígado mediante la sobreexpresión de EGFR . Además, según los estudios in vitro de captación celular y citotoxicidad para las células Hep G2, la endocitosis habilitada por el receptor de EGFR puede mejorar la Fe 3 O 4 pegilada. Tasa de captación de nanopartículas. Por lo tanto, la orientación establecida de Fe 3 O 4 PEGilado El sistema NP podría tener un gran potencial para la terapia por resonancia magnética del cáncer de hígado [143] .
Las nanopartículas de peróxido de hidrógeno (IONP) pueden acumularse en los tejidos tumorales debido a su extraordinario magnetismo . Estas partículas son agentes de contraste T2 que se detectan mediante resonancia magnética para controlar su acumulación en el tumor. Según estudios previos, las células cancerosas producen peróxido de hidrógeno (H2O2 ) a una velocidad de 0,5 nmol·10 células por hora. [144] La PDT, como modalidad de terapia contra el cáncer aprobada por la FDA, utiliza fotosensibilizadores no tóxicos, O2 , y ROS citotóxicos que generan luz, principalmente O2, para la mayoría de los fotosensibilizadores típicos para dañar oxidativamente las células cancerosas. Sin embargo, la capacidad inadecuada del O2 para dirigirse al tumor y el suministro de fotosensibilizador dentro del tumor sólido, el rango de difusión restringido de O 2 y la corta vida útil limitan poderosamente la eficiencia de la PDT. Para la administración de ftalocianina de zinc (ZnPc), se cargaron IONP dentro de la estructura similar a los estomatocitos de autoensamblaje de poli(etilenglicol)-poliestireno en bloque (PEG- b -PS) como nanomotores para transferir fotosensibilizadores a los tejidos tumorales y mejorar la eficiencia de la PDT. Bajo un campo magnético, los nanomotores híbridos (estomatocitos cargados con nanopartículas de óxido de hierro @ nanomotores de ZnPc, llamados ISP-NM) podrían recolectarse en los tejidos cancerosos como resultado del magnetismo de los IONP. Después de atraparlos por las células cancerosas, la descomposición del H 2 O 2 endógeno Puede ser catalizada por IONP que generan O 2 como fuerza impulsora del movimiento de los ISPNM. La distribución de ZnPc se expandió por las características de movimiento de los ISP-NM, lo que aumentó la distribución reactiva de ROS y mejoró la actividad de PDT. Además, el O 2 creado Se puede administrar para el procedimiento PDT, lo que garantiza su gran rendimiento. Además, los ISP-NM poseen una función de resonancia magnética nuclear porque los IONP son efectivos T 2 agentes de contraste ( Fig. 7 ) [145] .

- Descargar: Descargar imagen en alta resolución (240 KB)
- Descargar: Descargar imagen en tamaño completo
Figura 7 . Ilustración esquemática de la orientación tumoral del asistente de campo magnético de los ISP-NM y su 1O2 Producción y procedimiento de PDT para la terapia del cáncer. (Reimpreso de la publicación Ref. [145] , Copyright (2021), con permiso de Elsevier (código de licencia; 5157780493034).
Dado que la integración de PTT con inmunoterapia en la terapia del cáncer proporciona una estrategia eficaz, se diseñó un sistema de administración de MNP para cargar clorhidrato de R837 inmunoestimulante (R837) y verde de indocianina (ICG) para lograr una sinergia espaciotemporal entre inmunoterapia y PTT en el cáncer. Este sistema de administración comprende PEG como capa de recubrimiento para cargar R837 y Fe3O4 Las MNP como núcleo para cargar el ICG. Mediante inyección intravenosa, el recubrimiento de DPA-PEG condujo a una circulación prolongada, y la magnetización del superparamagnetismo, la función PA y PTT de la dosis de radiación interna médica (MIRD) permitió la obtención de imágenes multimodales fotoacústicas/fototérmicas y la focalización magnética. Aquí, se demostraron sistemáticamente potentes impactos profilácticos y terapéuticos con pocos efectos secundarios. Ventajosamente, la sinergia de la inmunoterapia y el PTT puede prevenir el crecimiento tumoral, la recurrencia y la metástasis. Por lo tanto, se obtuvieron potentes impactos terapéuticos anticancerígenos que representan una nueva área prometedora y de apertura para futuras investigaciones. [146] .
2.8. Polímeros magnéticos biocompatibles para la terapia del cáncer
El desarrollo de nanopartículas basadas en polímeros biodegradables y biocompatibles, como por ejemplo el poli(ácido láctico) y el poli(ácido glicólico), y sus copolímeros, despierta un gran interés entre los investigadores. Aunque son sintéticos, estos polímeros se degradan en el organismo en monómeros y oligómeros que se eliminan en mayor medida a través de las vías metabólicas normales, como el ciclo de Krebs [147] , [148] , [149] , [150] . Una vez que las nanopartículas poliméricas se administran por vía intravenosa, se someten a la reacción de opsonización, que provoca su fagocitosis a través de los monocitos-macrófagos. Para superar este problema, las partículas podrían recubrirse con polímeros hidrófilos , como el PEG, que evita el reconocimiento de las nanopartículas por parte del sistema reticuloendotelial [151] , [152] A continuación se analizan ejemplos recientes de polímeros biocompatibles utilizados para la terapia del cáncer.
Se diseñó y sintetizó un nuevo copolímero anfifílico termosensible y sensible al pH que contenía un bloque de PLA biodegradable e hidrofóbico y una sección hidrofílica de P(NIPAAm- co -HEMA- co -MAA- co -TMSPMA) mediante una combinación de polimerización por radicales libres y enfoques de apertura de anillo. Se cargaron simultáneamente dos fármacos anticancerígenos, MTX y DOX, en un nanocompuesto para fines de quimioterapia combinada contra el cáncer . La liberación simultánea de DOX/MTX mostró un comportamiento de liberación ayudado por el nicho tumoral (pH ≤ 5,4 y temperatura = 41 °C). Los hallazgos de citotoxicidad revelaron la no toxicidad del nanocompuesto recientemente desarrollado para las líneas celulares MCF7. La característica antitumoral del nanocompuesto cargado con DOX/MTX fue mayor que la de los fármacos libres descubiertos mediante tinción con 4',6-diamidino-2-fenilindol (DAPI), ensayo MTT, RT-PCR y análisis del ciclo celular en líneas celulares MCF-7. Los resultados revelaron que este nanocompuesto diseñado podría utilizarse con éxito en la administración dirigida de MTX y DOX a los tejidos tumorales y para más aplicaciones in vivo y clínicas. La biodegradabilidad, la biocompatibilidad, la no toxicidad, la liberación dirigida del fármaco, la estabilidad en el torrente sanguíneo y la capacidad de proteger el fármaco contra la descomposición in vivo son algunos de los beneficios del nanocompuesto diseñado utilizado en este estudio [153] .
En otro estudio, se informó sobre la obtención de MNP biocompatibles recubiertos con poli- L -lisina para la combinación de imágenes por resonancia magnética y la hipertermia magnética con el fin de unificar el método diagnóstico y terapéutico. En este estudio, se conjugaron MNP biocompatibles modificados con aminoácidos con anticuerpos específicos. Luego, las muestras se expusieron a mediciones calorimétricas . De acuerdo con las tasas de calentamiento aproximadas, se estimaron las tasas de absorción específicas para los MNP modificados con poli- L -lisina (MFPLL). Los valores calculados de la tasa de absorción específica (SAR) son apropiados para el estudio futuro que se centra en la detección de células cancerosas mediadas por anticuerpos y en la terapia en combinación con hipertermia e IRM. Los resultados obtenidos mostraron el importante efecto de la MFPLL en el tiempo de relajación transversal T2 con la relaxividad r 2 igual a 487,94 mM. Se encontró que la combinación significa un avance sustancial en la terapia de la enfermedad del cáncer y una mejora significativa en la supervivencia de los pacientes oncológicos. Los resultados revelaron la unión específica de MFPLL conjugado con anticuerpo a la proteína anhidrasa carbónica IX (CA IX) en un cultivo esferoidal tridimensional. Investigaciones anteriores han revelado características de internalización del receptor inducidas por anticuerpos de VII/20 Mab [154] que pueden ser cruciales para la administración de conjugados en células cancerosas y el uso probable de este conjugado es la terapia combinada contra el cáncer. La principal ventaja de MFPLL es la orientación selectiva de las células de cáncer colorrectal que puede ser importante para el posible uso de esta terapia combinada contra el cáncer conjugada [155] .
Se desarrolló un hidrogel natural sensible al pH magnético como sistema eficaz de administración de fármacos para el tratamiento del cáncer. En primer lugar, se oxidó el alginato (Alg) y, después, se reticuló la gelatina (gel) con Alg para producir un hidrogel químico Alg-Gel mediante una reacción de condensación de “desplazamiento de base”. A continuación, se integraron nanopartículas de Fe3O4 en el hidrogel mediante un método de coprecipitación química in situ. El resultado obtenido fue Alg-Gel / Fe3O4 Se cargó con DOX y se estudiaron las eficiencias de encapsulación, su carga de fármaco y su actividad anticancerígena contra células Hela. En pH = 4 (condición ácida), el Alg-Gel/Fe 3 O 4 -DOX mostró un mayor valor de liberación del fármaco que los de pH 7,4 y 37 °C (condición fisiológica). Se ha demostrado que el hidrogel magnético construido tiene un potencial brillante como sistema de administración de fármacos (DDS) para la quimioterapia contra el cáncer, principalmente debido a su mayor rendimiento que los del DOX libre en términos de comportamiento de liberación del fármaco dependiente del pH, perfil de liberación lenta del fármaco, característica magnética para el diagnóstico mediante resonancia magnética y aislamiento en el área objetivo. Con base en los resultados, el Alg-Gel/Fe 3 O 4 El hidrogel magnético puede estudiarse como un DDS inteligente para el diagnóstico y la terapia del cáncer. Las ventajas de Alg-Gel-DOX y Alg-Gel/Fe 3 O 4 -DOX sobre el DOX libre incluyen baja toxicidad, alta biodistribución, liberación lenta del fármaco y baja degradación del fármaco. [156] .
Zhang et al. desarrollaron con éxito nanopartículas multifuncionales encapsuladas con nanopartículas superparamagnéticas de Fe3O4 . Se cargó el fármaco olaparib (Olb) y la formulación se utilizó para el tratamiento multimodal del cáncer de mama triple negativo. Se eligió ácido hialurónico (AH) de bajo peso molecular para recubrir las nanopartículas. Debido a la alta afinidad entre el receptor CD44 en la superficie celular del cáncer de mama triple negativo (TNBC) y el ácido hialurónico, se pudo lograr una focalización eficaz para aplicar los efectos antitumorales sinérgicos tanto in vivo como in vitro. Mediante el tratamiento con campo magnético rotatorio (RMF), las HA-Olb-PPMNP (NP poliméricas multifuncionales) generaron una transferencia física de fuerza mecánica con una rotación imperfecta, por lo que las fuerzas de corte generadas por la rotación dañaron los lisosomas y alteraron la integridad de la membrana celular después de que las HA-Olb-PPMNP se internalizaran en las células, por lo que los efectos dañinos de "dos golpes" fueron evidentes a través de la microscopía confocal de barrido láser (CLSM) y el microscopio electrónico de barrido (SEM) ( Fig. 8 ). Por lo tanto, Olb y la fuerza mecánica aplican un efecto antitumoral dual para lograr una terapéutica sinérgica en presencia de RMF. Por lo tanto, la excitación magnética a través de la fuerza mecánica ofrece un enfoque emocionante para controlar de forma remota las funciones celulares para la terapia del cáncer. [157] .

- Descargar: Descargar imagen en alta resolución (781 KB)
- Descargar: Descargar imagen en tamaño completo
Figura 8 . Ilustración esquemática del daño celular visualizado por SEM y TEM. (A) Ilustración de los mecanismos anticancerígenos de magneto-apoptosis celular y magneto-lisis celular (B) Imágenes SEM de la integridad de la membrana celular dañada usando la acción de las HA-PPMNPs/HA-Olb-PPMNPs activadas por la terapia RMF (flecha roja). (C) Imágenes TEM ilustrativas de magneto-apoptosis celular desencadenada por HA-PPMNPs/HA-Olb-PPMNPs bajo tratamiento RMF (flecha azul: cuerpos apoptóticos, flecha amarilla: burbujas intracelulares y flecha verde: cariorrexis y cariopicnosis. (Reimpreso de la publicación Ref. [157] , Cpyright (2021), con permiso de Elsevier (código de licencia; 5157780661963).
2.9. Otros materiales magnéticos para la terapia del cáncer
Los nanopartículas teranósticas basadas en nanopartículas han surgido rápidamente en la última década y se han utilizado ampliamente en el diagnóstico y tratamiento de algunos tumores, como el cáncer de mama y el cáncer de hígado. Sin embargo, existen hallazgos limitados para los cánceres de piel. Hou et al. sintetizaron con éxito nanopartículas de CS-Fe 3 O 4 multifuncionales injertadas con IR820 (mediante la aplicación de IR820 en la superficie de óxido de hierro magnético recubierto con CS) para usos teranósticos en melanomas . Esta nanopartícula teranóstica muestra una excelente capacidad de resonancia magnética y efectos citotóxicos contra el melanoma bajo irradiación con un láser de infrarrojo cercano in vitro. Además, tienen una citotoxicidad insignificante y una alta estabilidad en la solución acuosa, hasta 8 días. Debido a las propiedades únicas, las nanopartículas de CS-Fe 3 O 4 IR820 Las nanopartículas ofrecieron un efecto citotóxico notable sobre las células A375 después de la irradiación con un láser NIR en comparación con la PDT convencional. Los resultados mostraron el buen potencial del IR820-CS-Fe 3 O 4 NP para el diagnóstico y tratamiento del melanoma [158] .
Las partículas magnéticas bacterianas biomineralizadas (BMP) se han investigado ampliamente para usos biomédicos con sus características magnéticas y una capa de biomembrana. Las BMP se han utilizado para la administración de fármacos dirigida magnéticamente, la hipertermia magnética, la obtención de imágenes por resonancia magnética, la detección magnética y la separación. [159] , [160] , [161] Las ventajas de los BMP sobre los MNP incluyen buena dispersión, gran producción, alta cristalinidad y magnetización cercana al volumen. [159] , [162] Wang et al. aplicaron por primera vez BMP para la terapia fototérmica dirigida magnéticamente de tumores in vivo. Las BMP se inocularon en el tejido tumoral mediante el imán constante bipolar en forma de C de fabricación propia con un gran campo magnético de gradiente en el sitio del tumor. Para el experimento simulado in vitro, las BMP tuvieron una gran tasa de mantenimiento en el área dirigida magnéticamente con diversas tasas de flujo. Con la orientación magnética, las BMP inoculadas con irradiación de luz NIR para la terapia fototérmica pueden causar una erradicación completa del tumor. Ofrece un método eficaz para los usos biomédicos de las BMP [163] .
En los últimos años, la combinación sinérgica de la tecnología de plasma y el sistema de administración de quimioterapia NP ha demostrado su capacidad en el tratamiento del cáncer. [164] Las ventajas únicas del CAP, que incluyen la esterilización, la curación con madera, la coagulación sanguínea, el blanqueamiento dental, la regeneración de la piel y la terapia contra el cáncer, han ayudado a los usos biomédicos recientes. [165] , [166] , [167] , [168] , [169] , [170] , [171] . Sin embargo, no existe ningún informe sobre CAP combinando MNP basadas en óxido de hierro. El impacto del co-tratamiento de MNP basadas en óxido de hierro y plasma atmosférico frío (CAP) se informó tanto in vivo como in vitro para la terapia dirigida contra el cáncer de pulmón. En este sentido, se estudiaron los impactos sinérgicos de MNP basadas en óxido de hierro y CAP sobre la expresión de EGFR, la bioactividad celular y las vías de señalización descendentes de EGFR ( Fig. 9 ). Los resultados revelaron que el co-tratamiento de MNP basadas en óxido de hierro y CAP puede evitar eficazmente la proliferación celular a través de la reducción de la viabilidad y la inducción de la apoptosis. En vivo El estudio revela que la combinación de CAP y MNP es útil para suprimir tumores de xenoinjerto. Por lo tanto, la combinación de CAP y MNP a base de óxido de hierro ofrece una herramienta prometedora para desarrollar un nuevo enfoque de terapia contra el cáncer. [172] .

- Descargar: Descargar imagen en alta resolución (278 KB)
- Descargar: Descargar imagen en tamaño completo
Figura 9 . Ilustración esquemática de los mecanismos moleculares por los que las MNP aumentan el efecto destructor selectivo de tumores de la CAP. Las especies reactivas originadas por la CAP darán como resultado un aumento significativo del H 2 O 2 intracelular, Fe 2+ /Fe 3+ Las MNP liberadas del lisosoma que comprenden pueden catalizar H 2 O 2 en OH, lo que provoca daños en las células carcinomatosas , por ejemplo, provocando apoptosis inducida por mitocondrias y roturas de ADN de doble cadena. (Reimpreso de Ref. [172] , Copyright (2021), con permiso de Elsevier (código de licencia; 5157780788522).
Munir et al. demostraron por primera vez que los agentes de recubrimiento aumentan el poder de magnetización y también reducen el tamaño de las partículas. En este estudio, la síntesis de nanopartículas de óxido de hierro sin recubrimiento y con recubrimiento de ácido málico (MA) y ácido cítrico (CA) se realizó mediante el enfoque de coprecipitación . Para el bioensayo in vivo, las nanopartículas con recubrimiento se inocularon dentro de las células tumorales seguido de la exposición a campos magnéticos alternos. En general, los resultados mostraron la mejor idoneidad de las nanopartículas de óxido de hierro con recubrimiento de MA y CA para tratar el cáncer de mama de ratones mediante terapia de hipertermia. La exposición al campo magnético alterno (AMF) de 15 mT y la frecuencia de 100 kHz durante 1 h resultó en un aumento de la temperatura (de 37 a 48 ° C) y también causó daño celular y posterior muerte celular apoptótica. En general, las nanopartículas de Fe3O4 funcionalizadas mostraron una reducción del tamaño de las partículas, características mejoradas y una mayor eficiencia para las terapias contra el carcinoma mediante hipertermia. Por lo tanto, las nanopartículas de óxido de hierro recubiertas con CA tienen un resultado significativo que podría ser muy útil en el futuro para superar las enormes pérdidas causadas por el cáncer de cuello uterino y de mama.
La terapia nanocatalítica en desarrollo puede catalizar in situ las sustancias endógenas en especies muy tóxicas y luego matar eficazmente las células tumorales; sin embargo, la falta de nanocatalizadores de alto rendimiento dificulta su amplia traducción clínica. Por primera vez, Dai et al. han desarrollado con éxito nanopartículas de hierro-polivinilpirrolidona cristalizadas de valencia cero (nZVCI-PVP) de tamaño nanométrico para provocar in situ una reacción nanocatalítica de Fenton dentro de TME para generar grandes cantidades de radicales hidroxilo y luego matar las células tumorales, que podrían aumentar de forma más sinérgica mediante hipertermia magnética o fotónica con la ayuda de estas nanopartículas de hierro que actúan como nanoagentes de conversión magnetotérmica o fototérmica, respectivamente ( Fig. 10 ). Este estudio no solo ofrece un nuevo tipo de nanopartículas a base de hierro para uso biomédico, sino que también revela la alta eficacia del tratamiento nanocatalítico del cáncer con la ayuda de la hipertermia magnética y fotónica. [173] .

- Descargar: Descargar imagen en alta resolución (308 KB)
- Descargar: Descargar imagen en tamaño completo
Figura 10 . La figura muestra el nZVCI-PVP para el tratamiento nanocatalítico sinérgico guiado por imágenes de RM ponderadas en T2 in vivo y la hipertermia fotónica y magnética del cáncer. (a) modificación del PVP de superficie de las nanopartículas de nZVCI, (b) funciones de imágenes de RM de las nanopartículas de nZVCI-PVP, (c) tratamiento nanocatalítico aumentado sinérgicamente y ablación tumoral fototérmica (d) tratamiento nanocatalítico aumentado sinérgicamente y ablación tumoral magnética con la ayuda de las nanopartículas de nZVCI-PVP. (Reimpreso de la publicación Ref. [173] , con permiso de Elsevier (código de licencia; 5157780928927).
3. Conclusiones y perspectivas futuras
Las MNP son muy prometedoras para su aplicación como potenciadores del contraste de imagen y agentes terapéuticos para cánceres que se tratan convencionalmente combinando quimioterapia, radioterapia y resección quirúrgica. Además, las MNP muestran un gran potencial para su utilización en el seguimiento de los tratamientos contra el cáncer y podrían proporcionar datos críticos a los médicos que les permitan adaptar los enfoques de tratamiento para ofrecer una atención ideal. Las MNP han experimentado un gran progreso por parte de los equipos de investigación en el mundo, pero aún así, se han aprobado formulaciones limitadas para aplicaciones clínicas. Muchos intentos de desarrollar MNP para la teranóstico del cáncer han continuado sin cesar. Existen algunos estudios clínicos en curso que aplican MNP para la terapia de hipertermia de diferentes tipos de cáncer. Además, los equipos de investigación siguen optimizando los procedimientos de síntesis para la funcionalización de las MNP mediante un agente bioterapéutico, quimioterapéutico y de contraste de imagen. La traducción de las MNP del laboratorio a la clínica requiere una comprensión completa de los efectos que tienen los parámetros de las MNP en las respuestas biológicas del ser humano. Muchas formulaciones de MNP no han logrado producir niveles aceptables de tratamiento en animales grandes y humanos; como lo que se observó en modelos de animales pequeños. Para aumentar la tasa de éxito de la traducción de las MNP a la clínica, los esfuerzos deben concentrarse en aumentar la capacidad de carga del fármaco, mejorar su afinidad y especificidad para las células tumorales diana y obtener capacidad de liberación del fármaco en función del microambiente. Además, la predicción de la mejor formulación de MNP para humanos se logra con la ayuda de mejores modelos animales teóricos. A medida que aumenta nuestra comprensión de la naturaleza de las MNP, tenemos la esperanza de que la combinación de imágenes y el tratamiento multimodal con MNP impulsará sus usos clínicos y afectará significativamente el tratamiento de los cánceres en el futuro cercano. Tabla 1 limita algunas características de los materiales magnéticos reportados para la terapia del cáncer.
Tabla 1 . Resumen de los materiales magnéticos reportados para la terapia del cáncer.
| Material | Objetivo | Característica específica | Ventajas y/o limitaciones | Árbitro. |
|---|---|---|---|---|
| SPION recubiertos con ácido poliacrílico | células tumorales de mama | anticuerpo anti-HER2 | Ventajas: Alta estabilidad, tamaño ultrapequeño y resistencia a la agregación. | [41] |
| Celda vacía | Limitación: reducir el efecto que se observa comúnmente en el calentamiento relacionado con la relajación browniana. | |||
| Nanopartículas PLGA cargadas con SPIONs/Cur/Ver | Cáncer de hígado HepG2 | Encapsulación PLGA | Ventajas: Estabilidad mejorada, toxicidad minimizada y eficiencia máxima del tratamiento. | [45] |
| SPION recubierto de PCL | células tumorales del hígado humano | SPION recubiertos de polímero | Ventajas: estabilidad estructural, mejor dispersión y citocompatibilidad. | [49] |
| Porfirina SPION conjugada con TZ | MCF7 | Nanopartículas conjugadas con anticuerpos | Ventajas: Baja citotoxicidad y solubilidad en agua. | [53] |
| SPION encapsulados en PA | células cancerosas | conjugado con biotina | Ventajas: buena capacidad de calentamiento y mayor capacidad de absorción por parte de las células cancerosas. | [54] |
| Celda vacía | Limitación: alta citotoxicidad. | |||
| FA-EuGd-MSNs-SS- L -cisteína (Cys) | Células hela | Objetivo de FA | Ventajas: Baja citotoxicidad, alta estabilidad, diagnóstico y tratamiento simultáneos. | [68] |
| MnSiO3 @ Fe3O4 | Célula HeLa | – | Ventajas: Disminución de la toxicidad y seguimiento en tiempo real de la liberación del fármaco. | [73] |
| FA-Gd-Tb@ SiO2 | Células tumorales | – | Ventajas: Nanofármaco favorable, dirigido, multifuncional y de tamaño controlado, excelente efecto fototérmico y excelente rendimiento en respuesta al pH en la liberación y carga del fármaco. | [76] |
| Esferas de IONP encapsuladas en CTAB | Células HeLa | – | Ventajas: Generación sencilla a gran escala, tamaño de poro uniforme ajustable, gran área superficial y grandes volúmenes de poro. | [67] |
| Celda vacía | Limitación: Tóxico en altas concentraciones de CTAB. | |||
| Nanofármacos Fe3O4 @ SiO2 @ DOX | Células tumorales pulmonares A549 | – | Ventajas: efecto quimio/fototérmico sinérgico excepcional y alta citotoxicidad y captación celular. | [77] |
| Apt-Au - Fe3O4 | Células tumorales de ovario SKOV-3 | aptámeros funcionalizados | Ventajas: gran afinidad de unión, tamaño pequeño, alta especificidad y no inmunogenicidad. | [84] |
| Celda vacía | Limitación: Selectividad limitada que los restringe en la orientación celular y la liberación exacta de aptámeros. | |||
| MGN@Ce 6 @RT | Tumores TNBC | Doble focalización cRGD/TPP | Ventajas: Excelente biocompatibilidad, identificación y tratamiento de TNBC de alta eficiencia y precisión | [99] |
| Gd-CS-OA/Ce 6 | Células 4T1 | – | Ventajas: biocompatibilidad y estabilidad deseables. | [112] |
| GdPO4 /CS / Fe3O4 | metástasis óseas del cáncer de mama | – | Ventajas: Aumenta la apoptosis y evita la recurrencia del cáncer. | [123] |
| Celda vacía | Limitación: Baja solubilidad en agua. | |||
| GAG@ mSiO2 @RB | cánceres profundos | – | Ventajas: Biocompatibilidad, no inmunogenicidad y alta eficiencia de fotoluminiscencia. | [124] |
| Apt- Fe3O4 @ C @DOX | Células A549 | funcionalizado con aptámeros | Ventajas: Excelente biocompatibilidad, alta eficacia terapéutica, excelente capacidad de focalización activa sobre tumores. | [131] |
| Ag@ Fe3O4 @ C -PEG-FA/DOX | Células tumorales | PEG de múltiples brazos | Ventajas: Buenos impactos fototérmicos y liberación mejorada de DOX, biocompatibilidad y estabilidad excepcionales. | [133] |
| CD44/CD133-ATRA-PLPN | cáncer gástrico | ATRA-PLPN conjugado con anticuerpos | Ventajas: focalización eficaz y específica, mayor biodistribución y endocitosis mejorada de las nanopartículas en las células tumorales. | [140] |
| Celda vacía | Limitaciones: La dificultad de la obtención de imágenes ópticas debido al bajo número de células madre de cáncer gástrico en la masa tumoral. | |||
| NP magnéticas recubiertas de poli- L- lisina (MFPLL) | células de cáncer colorrectal | conjugación con anticuerpos específicos | Ventajas: Orientación selectiva | [154] |
| Gel de algas/ Fe3O4 - DOX | Células hela | – | Ventajas: Baja toxicidad, alta biodistribución, liberación lenta del fármaco y baja degradación del fármaco. | [156] |
| PPMNP HA-Olb | TNBC | – | Ventajas: Orientación eficaz | [157] |
| CS- Fe3O4 injertado con IR820 | Célula de melanoma de piel | – | Ventajas: Citotoxicidad insignificante y alta estabilidad. | [158] |
*FA (ácido fólico).
Declaración de contribución de autoría de CRediT
Doctor Baghban: Roles/Escritura - Borrador original; Análisis formal; Investigación. Dr. Afarid : Redacción, revisión y edición, investigación. Doctora Soleymani: Administración de proyectos; Supervisión; Conceptualización; Investigación; Roles/Redacción - borrador original; Redacción - revisión y edición. Dra. Rahimi: Administración de proyectos; Supervisión; Conceptualización; Investigación; Roles/Redacción - borrador original; Redacción - revisión y edición.
Declaración de conflicto de intereses
Los autores declaran que no tienen ningún interés financiero en competencia ni relaciones personales conocidas que pudieran haber parecido influir en el trabajo presentado en este artículo.
Expresiones de gratitud
RB y MA desean agradecer el apoyo de Universidad de Ciencias Médicas de Shiraz (Shiraz, Irán) y JS quisiera agradecer el apoyo de Universidad de Ciencias Médicas de Tabriz (Tabriz, Irán) . MR agradece el apoyo financiero de Centro Nacional de Ciencias, Polonia , a través de una subvención UMO-2018/29/B/ST5/02412 .
Referencias
-
[1]
Avances recientes en sistemas de administración de fármacos basados en nanopartículas para la terapia del cáncerMedicina Biológica del Cáncer, 14 (3) (2017), págs. 228-241
-
[2]
Nuevos conocimientos sobre el diseño de nanopartículas híbridas para el cáncer de pulmón: diagnóstico y tratamientoJ. Control. Liberación, 295 (2019), págs. 250-267
-
[3]
Nanopartículas magnéticas en la terapia y el diagnóstico del cáncerAbogado de Salud y Maestría, 9 (9) (2020), pág. 1901058
-
[4]
Nanopartículas multifuncionales para la obtención de imágenes y el tratamiento de tumores cerebralesAbogado de entrega de medicamentos, Rev. 66 (2014), págs. 42-57
-
[5]
Terapia del cáncer: nanoterapéutica del cáncer: mejora de la imagenología y la terapia mediante la administración dirigida a través de barreras biológicas (adv. Mater. 36/2011)Abogado Mater., 23 (36) (2011), págs. H209-H309-47
-
[6]
Desarrollo y caracterización de un nuevo nanocompuesto conductor de polianilina-g-poliestireno/Fe3O4 para el tratamiento del cáncerCélulas artificiales, nanotecnología, biotecnología 47 (1) (2019), págs. 873-881
-
[7]
Nanopartículas de magnetita para el diagnóstico, tratamiento y seguimiento del cáncer: avances recientesMater. Hoy, 19 (3) (2016), págs. 157-168
-
[8]
Síntesis mediada por PEG de nanopartículas superparamagnéticas multifuncionales altamente dispersivas: sus propiedades fisicoquímicas y función in vivoNano ACS, 4 (4) (2010), págs. 2402-2410
-
[9]
Nanopartículas magnéticas de óxido de hierro soportadas en KCC-1 funcionalizado con aminopropilo como catalizador robusto y reciclable para la síntesis ecológica y en un solo recipiente de tetrahidrodipirazolopiridinas y evaluación de citotoxicidadQuímica Organometálica Aplicada, 34 (3) (2020)
-
[10]
Preparación, funcionalización superficial y aplicación de nanopartículas magnéticas de Fe3O4Ciencia avanzada en interfase coloidal 281 (2020), Artículo 102165
-
[11]
Exosomas sanguíneos dotados de propiedades magnéticas y de focalización para la terapia del cáncerNano ACS, 10 (3) (2016), págs. 3323-3333
-
[12]
Los exosomas derivados de tumores son una fuente de antígenos de rechazo tumoral compartidos para la preparación cruzada de CTLMedicina Natural, 7 (3) (2001), págs. 297-303
-
[13]
Exosomas liberados por tumores y sus implicaciones en la inmunidad contra el cáncerDiferencia entre muerte celular 15 (1) (2008), págs. 80-88
-
[14]
Las microvesículas liberadas de células madre de cáncer renal humano estimulan la angiogénesis y la formación del nicho premetastásico pulmonarRes. del cáncer, 71 (15) (2011), págs. 5346-5356
-
[15]
Administración conjunta de doxorrubicina y metotrexato mediante quitosano dendrítico-g-mPEG como nanotransportador magnético para la administración de múltiples fármacos en quimioterapia combinadaQuímica polimérica, 8 (47) (2017), págs. 7333-7350
-
[16]
Nanoflores híbridas de enzimas e inorgánicas con nanopartículas magnéticas incrustadas con actividad similar a la peroxidasa mejorada y canalización de sustrato para biodetección de glucosaAbogado de Salud y Maestría, 8 (9) (2019), pág. 1801507
-
[17]
La hipertermia con nanopartículas magnéticas controladas por temperatura inhibe el crecimiento del tumor primario y la diseminación de metástasisNanomed.: Nanotecnología. Biol. Med., 25 (2020), Artículo 102171
-
[18]
Nanopartículas magnéticas como agentes de contraste para resonancia magnéticaSurf. -Modif. Nanobiomater. Electroquímica. Apl. Biomédica. (2020), págs. 49-91
-
[19]
Imágenes tomográficas por partículas magnéticas de nanopartículas dirigidas al cáncerNanoescala, 9 (47) (2017), págs. 18723-18730
-
[20]
Tendencias actuales en modificaciones químicas de nanopartículas magnéticas para la administración dirigida de fármacos en quimioterapia contra el cáncerMetabolismo de fármacos Rev., 52 (1) (2020), págs. 205-224
-
[21]
Modificación de la superficie de nanopartículas de óxido de hierro magnéticoNanomateriales, 8 (10) (2018), pág. 810
-
[22]
M. Angelakeris, Nanopartículas magnéticas: un vehículo multifuncional para la teranóstica moderna, Biochim. Biophys. Acta (BBA)-Gen. Subj. 1861(6) (2017) 1642–1651.
-
[23]
Desarrollo de nanopartículas superparamagnéticas recubiertas con ácido poliacrílico e hidróxido de aluminio como agente de contraste eficiente para imágenes multimodalesNanomateriales, 9 (11) (2019), pág. 1626
-
[24]
Hipertermia dirigida con nanopartículas magnéticas para el tratamiento del cáncer oralJ. Medicina Oral y Patológica, 48 (9) (2019), págs. 803-809
-
[25]
Efectos de la hipertermia local y de cuerpo entero sobre la inmunidadHyperth. Tratamiento del cáncer: un ensayo clínico preliminar. (2006), págs. 247-275
-
[26]
Hipertermia versus oncotermia: efectos celulares en la terapia complementaria del cáncerComplemento basado en evidencia. Medicina alternativa. 2013 (2013)) (2013), págs. 1-12
-
[27]
Hipertermia con nanopartículas magnéticas: tecnologías electromagnéticas emergentes para enfermedades cerebralesDiagnóstico, monitorización, terapia, Springe (2018), págs. 129-191
-
[28]
Capítulo 16 - Hipertermia cancerosa mediada por nanopartículas magnéticasS. Pablo, D. Bhatia (Eds.), Atención sanitaria inteligente para el diagnóstico y la prevención de enfermedades, Prensa académica (2020), págs. 153-173
-
[29]
Nanopartículas magnéticas para hipertermia en el tratamiento del cáncer: una herramienta emergenteCiencia ambiental Res. contaminacion. 27 (16) (2020), págs. 19214-19225
-
[30]
Estudio multiinstitucional de sarcomatosis peritoneal a partir de sarcoma uterino tratado con cirugía citorreductora y quimioterapia intraperitoneal hipertérmicaRevista Europea de Cirugía Oncológica, 43 (11) (2017), págs. 2170-2177
-
[31]
Hipertermia magnética administrada sistémicamente para el tratamiento del cáncer de próstataFarmacia, 12 (11) (2020), pág. 1020
-
[32]
Tratamiento de ratones BALB/c con cáncer de mama mediante hipertermia magnética utilizando nanopartículas de óxido de hierro funcionalizadas con dendrímerosNanomateriales, 10 (11) (2020), pág. 2310
-
[33]
Nanopartículas de óxido de hierro teranósticas de orientación activa para la ablación por ultrasonidos focalizados guiada por resonancia magnética y resonancia magnética del cáncer de pulmónBiomateriales, 127 (2017), págs. 25-35
-
[34]
La deposición de inmunoglobulina en la corona de biomoléculas determina la eficiencia de opsonización del complemento de nanopartículas preclínicas y clínicasNanotecnología nacional, 14 (3) (2019), págs. 260-268
-
[35]
Implicación de las nanopartículas magnéticas en la detección, el cribado y el tratamiento del cáncerMagnetoquímica, 5 (4) (2019), pág. 55
-
[36]
Nanopartículas: propiedades, aplicaciones y toxicidadesRevista Árabe de Química, 12 (7) (2019), págs. 908-931
-
[37]
Nanopartículas superparamagnéticas de óxido de hierro: aplicaciones médicas actuales y futurasMateriales, 12 (4) (2019), pág. 617
-
[38]
Contraste in vivo de alta sensibilidad para imágenes por resonancia magnética de campo ultrabajo utilizando nanopartículas de óxido de hierro superparamagnéticasCiencias Adv., 6 (29) (2020), pág. eabb0998
-
[39]
Estudios exhaustivos de citotoxicidad de nanopartículas superparamagnéticas de óxido de hierroBioquímica. Biofísica. Rep., 13 (2018), págs. 63-72
-
[40]
Óxidos de hierro superparamagnéticos como trazadores de MPI: introducción y revisión de las primeras aplicacionesAbogado de entrega de medicamentos, Rev. 138 (2019), págs. 293-301
-
[41]
Calentamiento por inducción basado en nanopartículas a magnitudes bajas de intensidad de campo magnético para la terapia del cáncer de mamaJ. Magn. Magn. Mater., 483 (2019), págs. 169-177
-
[42]
Nanopartículas de óxido de hierro para administración de fármacos guiada magnéticamente y con respuesta magnéticaRevista Internacional de Ciencias Moleculares, 16 (4) (2015), págs. 8070-8101
-
[43]
Nanopartículas superparamagnéticas de óxido de hierro para el diagnóstico y el tratamiento del cáncerJ. Biomed. Nanotecnología. 15 (2) (2019), págs. 215-416
-
[44]
Preparación y caracterización de nanopartículas superparamagnéticas de óxido de hierro para la administración de fármacos guiada magnéticamenteRevista Internacional de Medicina Nuclear, 13 (2018), págs. 43-46
-
[45]
Ferrofluidos multifuncionales basados en nanopartículas poliméricas magnéticas para el tratamiento multimodal in vitro del cáncer mediante termoterapia y quimioterapiaJ. Mol. Líquido, 293 (2019), Artículo 111549
-
[46]
Nanopartículas de PLGA encapsuladas con SPION altamente versátiles como abladores fototérmicos de células cancerosas y como agentes de imágenes multimodalesBiomater. Ciencias, 5 (3) (2017), págs. 432-443
-
[47]
Estudio in vitro de nanopartículas multifuncionales PLGA-SPION cargadas con gemcitabina como radiosensibilizador utilizado en radioterapiaIrán. J. Pharm. Res.: IJPR, 18 (4) (2019), págs. 1694-1703
-
[48]
Terapia de hipertermia magnética para el tratamiento del glioblastoma: una revisión de la historia, eficacia y aplicación de la terapia en humanosInt. J. Hyperth., 34 (8) (2018), págs. 1316-1328
-
[49]
Nanopartículas superparamagnéticas de óxido de hierro recubiertas de policaprolactona para la terapia de hipertermia magnética in vitro del cáncerJuez europeo de polímeros, 133 (2020), Artículo 109789
-
[50]
Hipertermia in vitro con estabilidad coloidal mejorada y SAR mejorado de nanoestructuras de núcleo/capa magnéticaIngeniería en Ciencias de la Computación: C., 59 (2016), págs. 702-709
-
[51]
Síntesis hidrotermal de nanopartículas de Fe3O4 mediante HEPES y su aplicación biológicaAbogado de la RSC, 5 (7) (2015), págs. 5059-5067
-
[52]
Conjugación de anticuerpos de nanopartículas como terapia para el tratamiento del cáncer de mamaRevista Internacional de Ciencias Moleculares, 21 (17) (2020), pág. 6018
-
[53]
Nanopartícula de óxido de hierro superparamagnético conjugada con porfirina y trastuzumab: un posible agente bimodal PTT-MRI para el cáncer de mama positivo a herceptinaFoto Fotodinámica Termodinámica, 31 (2020), Artículo 101896
-
[54]
Encapsulación de nanopartículas superparamagnéticas de óxido de hierro con biopolímero de poliaspartamida para terapia de hipertermiaJuez europeo de polímeros, 122 (2020), Artículo 109396
-
[55]
Un sistema de administración dirigido a las superficies de formación ósea para facilitar la terapia anabólica basada en ARNiMedicina Natural, 18 (2) (2012), págs. 307-314
-
[56]
La inhibición de la furina mediante nanopartículas superparamagnéticas de óxido de hierro dirigidas al hueso alivió la metástasis ósea del cáncer de mamaBioact. Mater., 6 (3) (2021), págs. 712-720
-
[57]
Nanopartículas de sílice mesoporosas multifuncionales con un controlador de respuesta térmica para la quimioterapia/fototerapia activada por luz NIRPequeño, 12 (31) (2016), págs. 4286-4298
-
[58]
Sistemas duales de administración de gemcitabina asistida por reacción enzimática para la terapia programada del cáncer de páncreasNano ACS, 11 (2) (2017), págs. 1281-1291
-
[59]
Nanoestructuras peptídicas autoensambladas, termoestables, resistentes a proteasas y estabilizadas en hélice como posibles inhibidores de interacciones proteína-proteínaBiomacromoléculas, 14 (8) (2013), págs. 2684-2689
-
[60]
Manejo de la inmunogenicidad no deseada de los productos biológicosAutoinmune. Rev., 14 (7) (2015), págs. 569-574
-
[61]
Conjugados péptido-nanopartículas: ¿una próxima generación de plataformas diagnósticas y terapéuticas?Nano convergencia, 5 (1) (2018), págs. 1-18
-
[62]
Síntesis de nanofibras dendríticas dopadas con terbio funcionalizadas con ácido fólico e interacción con células normales HEK 293, células de cáncer de mama MDA y células de cáncer de colon HT 29J. Mol. Reconocimiento., 33 (11) (2020), pág. 2871
-
[63]
Citodetección altamente sensible y específica de células de cáncer colorrectal HT 29 utilizando nanopartículas KCC-1 funcionalizadas con ácido fólicoBiosens. Bioelectron., 132 (2019), págs. 122-131
-
[64]
Una ruta sencilla para obtener nanoesferas huecas de sílice mesoporosa con tamaño ajustableQuímica Común, 23 (2008), págs. 2629-2631
-
[65]
Nanoestructuras mesoporosas huecas/de tipo sonajero mediante una estrategia de grabado selectivo basada en diferencias estructuralesNano ACS, 4 (1) (2010), págs. 529-539
-
[66]
Microestructuras/nanoestructuras huecas: síntesis y aplicacionesAbogado Mater., 20 (21) (2008), págs. 3987-4019
-
[67]
Esferas de sílice mesoporosa huecas de nanopartículas de óxido de hierro magnético: fabricación y posible aplicación en la administración de fármacosFísica Aplicada Curr., 20 (2) (2020), págs. 320-325
-
[68]
Preparación y caracterización de nanopartículas de sílice mesoporosas multifuncionales para la obtención de imágenes por resonancia magnética dual y fluorescencia en terapias dirigidas contra el cáncerMateria mesoporosa microporosa. 250 (2017), págs. 210-220
-
[69]
Liberación controlada intracelular inducida por células de cisteína impermeable a la membrana a partir de un sistema de administración de fármacos basado en nanopartículas de sílice mesoporosasQuímica Común, 22 (2009), págs. 3219-3221
-
[70]
RW Rand, HD Snow, DG Elliott, GM Haskins, Método de calentamiento por inducción para su uso en la causa de necrosis de neoplasia, Google Patents, 1985.
-
[71]
Inmunoterapia contra el cáncer basada en hipertermia intracelular mediante nanopartículas de magnetita: un nuevo concepto de “necrosis controlada por calor” con expresión de proteínas de choque térmicoInmunología del cáncer. Inmunoterapia. 55 (3) (2006), págs. 320-328
-
[72]
Nanomateriales magnéticos para terapia basada en hipertermia y administración controlada de fármacosAbogado de entrega de medicamentos, Rev. 63 (9) (2011), págs. 789-808
-
[73]
Una nanoplataforma biodegradable de MnSiO3@ Fe3O4 para la terapia combinatoria del cáncer guiada por imágenes de resonancia magnética de modo dualBiomateriales, 194 (2019), págs. 151-160
-
[74]
Andamios porosos modificados con nanopartículas magnéticas para regeneración ósea y terapia fototérmica contra tumoresNanomed.: Nanotecnología. Biol. Med., 14 (3) (2018), págs. 811-822
-
[75]
Preparación de nanopartículas magnéticas de doble núcleo-capa de Fe3O4@SiO2@ácido tánico mediante la estrategia de reacción multicomponente Ugi como coadministración sensible al pH de doxorrubicina y metotrexatoMatemáticas, Química y Física. 247 (2020), Artículo 122857
-
[76]
Nanopartículas de sílice magnetoluminiscentes dirigidas a tumores para la obtención de imágenes por resonancia magnética/luminiscencia controlada por tiempo bimodal de células cancerosas in vitro e in vivoTalanta, 220 (2020), Artículo 121378
-
[77]
Fotosensibilizador nano-Fe3O4 magnético recubierto de SiO2 para terapia quimio-fototérmica sinérgica dirigida a tumoresColoides Surf. B: Biointerfaces, 195 (2020), Artículo 111274
-
[78]
Liberación de fármacos fotoactivables a partir de nanopartículas plasmónicas para terapia dirigida contra el cáncerNano ACS, 5 (10) (2011), págs. 7796-7804
-
[79]
Estudios experimentales y teóricos de la conversión de luz en calor y de los efectos del calentamiento colectivo en soluciones de nanopartículas metálicasNano Letras, 9 (3) (2009), págs. 1139-1146
-
[80]
Una síntesis sencilla de un solo paso de nanopartículas magnetoplasmónicas multinúcleo ternariasNanoescala, 6 (7) (2014), págs. 3532-3535
-
[81]
Avances recientes en síntesis y aplicaciones de nanopartículas tipo mancuernaAbogado Mater., 21 (30) (2009), págs. 3045-3052
-
[82]
Nanopartículas de Au− Fe3O4 con forma de mancuerna para administración de platino específica para un objetivoJ. Am. Química Social, 131 (12) (2009), págs. 4216-4217
-
[84]
Administración de aptámeros fotocontrolados mediante nanopartículas magnéticas de oro de doble superficie para terapia dirigida contra el cáncerIngeniería en Ciencias de la Computación: C., 80 (2017), págs. 88-92
-
[85]
Nanobarras de oro modificadas con dendrímeros conjugados con RGD para la focalización de tumores in vivo y la terapia fototérmicaFarmacia Mol., 7 (1) (2010), págs. 94-104
-
[86]
Teranósticos: combinando imágenes y terapiaQuímica bioconjugada, 22 (10) (2011), págs. 1879-1903
-
[87]
Nanopartículas multifuncionales para imágenes multimodales y teragnósticoSociedad Química Rev., 41 (7) (2012), págs. 2656-2672
-
[88]
Un sistema de administración de hidrogel de quitosano para la terapia génica del osteosarcoma con factor derivado del epitelio pigmentario combinado con quimioterapiaBiomateriales, 30 (27) (2009), págs. 4815-4823
-
[89]
Aumento de la toxicidad de los fármacos quimioterapéuticos contra el cáncer mediante hipertermia con nanobarras de oroAbogado Mater., 20 (20) (2008), págs. 3832-3838
-
[90]
Nanopartículas de sílice mesoporosa magnéticas recubiertas de puntos cuánticos de grafeno como plataforma multifuncional para la administración controlada de fármacos, la hipertermia magnética y la terapia fototérmicaPequeño, 13 (2) (2017), pág. 1602225
-
[91]
La coadministración de iRGD con nanopartículas reactivas de múltiples etapas mejoró la capacidad de penetración y focalización del tumor para la terapia del cáncer de mamaInterfaces de material de aplicación ACS 10 (26) (2018), págs. 22571-22579
-
[92]
Nanopartículas con liberación de NO mejorada por láser y reducción de tamaño activada por enzimas para penetración profunda en tumores y terapia combinadaBiomateriales, 168 (2018), págs. 64-75
-
[93]
¿Pueden los nanohíbridos magnetoplasmónicos combinar eficientemente la fototermia con la hipertermia magnética?Nanoescala, 7 (45) (2015), págs. 18872-18877
-
[94]
Administración de fármacos mejorada fototérmicamente mediante nanocristales ultrapequeños multifuncionales de capa de grafito y FeCoNano ACS, 5 (2) (2011), págs. 1505-1512
-
[95]
Efecto sinérgico de la terapia quimio-fototérmica utilizando óxido de grafeno PEGiladoBiomateriales, 32 (33) (2011), págs. 8555-8561
-
[96]
Nanopartículas magnéticas de oro multifuncionales para una administración eficaz y dirigida de fármacos y terapia fototérmica intersticialInt. J. Farmacéutica, 554 (2019), págs. 256-263
-
[97]
Glóbulos rojos teranósticos multifuncionales para la terapia combinada in vivo del cáncer potenciada por campos magnéticosAbogado Mater., 26 (28) (2014), págs. 4794-4802
-
[98]
Aplicaciones terapéuticas de CRISPR/Cas9 en el cáncer de mama y potencial de administración de nanomateriales de oroNanobiomedicina, 7 (1849543520983196) (2020)
-
[99]
Nanoheteroestructura magnética de oro dirigida a las mitocondrias para la terapia fototérmica y fotodinámica guiada por imágenes multimodales del cáncer de mama triple negativoIngeniero Químico J., 403 (2021), Artículo 126364
-
[100]
Nanopartículas basadas en polisacáridos para nanomedicina teranósticaAbogado de entrega de medicamentos, Rev. 99 (2016), págs. 70-84
-
[101]
Captación selectiva de micelas poliméricas de quitosano por monocitos circulantes para una mejor focalización tumoralCarbohidr. Polímero, 229 (2020), Artículo 115435
-
[102]
Sistema de administración de nanofármacos lipídicos modificados con quitosano para el tratamiento específico y eficaz de la colitis ulcerosaCarbohidr. Polímero, 230 (2020), Artículo 115613
-
[103]
Fabricación y estudio de nanopartículas cargadas de curcumina basadas en folato-quitosano para su aplicación en la terapia del cáncer de mamaCarbohidr. Polímero, 168 (2017), págs. 14-21
-
[104]
Inhibición del estroma promotor de tumores para reforzar la posterior focalización de AT1R en las células tumorales mediante micelas de inspiración patológicaBiomateriales, 161 (2018), págs. 33-46
-
[105]
Nanopartículas modificadas con polisacáridos con capacidad de dirigirse inteligentemente al receptor CD44 para la administración de genesRevista Internacional de Medicina Nuclear, 13 (2018), págs. 3989-4002
-
[106]
Conjugados de polisacáridos reticulados con boronato para administración de fármacos dirigida y sensible al pHQuímica Común, 55 (8) (2019), págs. 1164-1167
-
[107]
Nanopartículas híbridas de núcleo y capa magnéticas para terapias contra el cáncer dirigidas a receptores e imágenes por resonancia magnéticaJ. Ciencia de la interfaz coloidal. 486 (2017), págs. 112-120
-
[108]
Diseño de sistemas de administración de fármacos que contienen artemisinina y sus derivadosMoléculas, 22 (2) (2017), pág. 323
-
[109]
Nanopartículas magnéticas de quitosano cargadas con artemisinina para una focalización eficaz del cáncer de mamaInt. J. Biol. Macromol., 104 (2017), págs. 1853-1859
-
[110]
Un enfoque simple para diseñar nanopartículas de Fe3O4 funcionalizadas con quitosano para la administración de doxorrubicina en función del pH para la terapia contra el cáncerJ. Magn. Magn. Mater., 448 (2018), págs. 199-207
-
[111]
Un nuevo nanocompuesto magnético de núcleo-capa biocompatible basado en hidrogeles de quitosano reticulados para la hipertermia in vitro en la terapia del cáncerInt. J. Biol. Macromol., 140 (2019), págs. 407-414
-
[112]
Nanopartículas de glicolípidos derivados del quitosano para la terapia fotodinámica guiada por resonancia magnética del cáncerCarbohidr. Polímero, 245 (2020), Artículo 116509
-
[113]
Nanopartículas como sistemas de administración de fármacos en la medicina del cáncer: énfasis en los nanoliposomas que contienen ARNiProductos farmacéuticos, 6 (11) (2013), págs. 1361-1380
-
[114]
Complejos metálicos en la terapia contra el cáncer: una actualización desde la perspectiva del diseño de fármacosDes. de fármacos, terap. de desarrollo 11 (2017), págs. 599-616
-
[115]
Nanopartículas inorgánicas en la terapia contra el cáncerRes. Farmacéutica, 28 (2) (2011), págs. 237-259
-
[116]
Propiedades y aplicaciones de las nanopartículas coloidales no esféricas de metales noblesAbogado Mater., 22 (16) (2010), págs. 1805-1825
-
[117]
Aplicaciones biológicas de las nanopartículas de oroSociedad Química Rev., 37 (9) (2008), págs. 1896-1908
-
[118]
Modificación superficial, funcionalización y bioconjugación de nanopartículas inorgánicas coloidalesFilosofía, Trad. R. Soc. A: Matemáticas, Física, Ingeniería, Ciencias. 368 (1915) (2010), págs. 1333-1383
-
[119]
Nanopartículas de oro en aplicaciones de administraciónAbogado de entrega de medicamentos, Rev. 60 (11) (2008), págs. 1307-1315
-
[120]
Los nanotransportadores se preparan para una larga vidaNanotecnología nacional, 2 (4) (2007), págs. 203-204
-
[121]
Comprender la eficiencia de conversión fototérmica de los nanocristales de oroPequeño, 6 (20) (2010), págs. 2272-2280
-
[122]
Nanopartículas para la terapia térmica del cáncerJ. Ingeniería Biomecánica, 131 (7) (2009), Artículo 074001
-
[123]
La disposición ordenada de nanobarras de GdPO4 hidratadas en una matriz magnética de quitosano promueve la terapia fototérmica tumoral y la regeneración ósea contra las metástasis óseas del cáncer de mamaIngeniero Químico J., 381 (2020), Artículo 122694
-
[124]
Nanopartículas de granate de aluminio y gadolinio dopado con cerio y luminiscentes magnéticas para la obtención simultánea de imágenes y terapia fotodinámica de células cancerosasJ. Ciencia de la interfaz coloidal. 526 (2018), págs. 220-229
-
[125]
Nanopartículas magnéticas funcionalizadas cargadas con disulfiram combinadas con nitroprusiato de sodio y cobre en células de cáncer de mamaIngeniería en Ciencias de la Computación: C., 119 (2021), Artículo 111452
-
[126]
Síntesis sencilla de nanopartículas biocompatibles basadas en Fe3O4 para la erradicación de tumores guiada por resonancia magnética de modelo dual sensible al pH mediante terapia fototérmicaChin. J. Anal. Química, 47 (5) (2019), págs. 678-685
-
[127]
Nanomateriales basados en carbono: materiales multifuncionales para ingeniería biomédicaNano ACS, 7 (4) (2013), págs. 2891-2897
-
[128]
Nanomateriales basados en carbono como plataforma emergente para la teranósticaMater.Horiz., 6 (3) (2019), págs. 434-469
-
[129]
Nanomateriales no metálicos en la terapia antineoplásica: una revisión de los sistemas de administración de fármacos basados en sílice y carbonoMaestría en Ciencias y Tecnología, 14 (4) (2013), Artículo 044407
-
[130]
Orientación contra el cáncer y administración de fármacos mediante puntos cuánticos y nanotubos basados en carbonoMoléculas, 23 (2) (2018), pág. 378
-
[131]
Terapia del cáncer guiada por imágenes utilizando nanopartículas de carbono Fe3O4@ magnéticamente sensibles y reticuladas funcionalizadas con aptámerosActa Anal Chim., 1056 (2019), págs. 108-116
-
[132]
Vries, Superar la barrera hematoencefálica tumoral para un tratamiento eficaz del glioblastomaResistencia a los medicamentos. Actualizaciones, 19 (2015), págs. 1-12
-
[133]
Nanopartículas de Ag@ Fe3O4@ C para la focalización sinérgica quimiofototérmica guiada por imágenes multimodales para la terapia del cáncerActa Anal Chim., 1086 (2019), págs. 122-132
-
[134]
Los polietilenglicoles anfipáticos prolongan eficazmente el tiempo de circulación de los liposomas.FEBS Carta, 268 (1) (1990), págs. 235-237
-
[135]
Estudio farmacocinético y de fase I de Genexol-PM, un paclitaxel formulado en micelas poliméricas y sin cremóforo, en pacientes con neoplasias malignas avanzadasClínica de Cáncer, 10 (11) (2004), págs. 3708-3716
-
[136]
Nanopartículas anfifílicas basadas en PEG dirigidas al microambiente tumoral para superar la quimiorresistenciaNanomed.: Nanotecnología, Biol. Med., 12 (2) (2016), págs. 269-286
-
[137]
Nanopartículas magnéticas reticuladas con un enlace amida biocompatible para la obtención de imágenes por resonancia magnética y óptica dual dirigidas al cáncerColoides Surf. B: Biointerfaces, 161 (2018), págs. 183-191
-
[138]
Tendencias actuales en terapias dirigidas para infecciones resistentes a fármacosMicrobiología aplicada, Biotecnología. 103 (20) (2019), págs. 8301-8314
-
[139]
La ingeniería de anticuerpos promueve la nanomedicina para el tratamiento del cáncerNanomedicina, 5 (8) (2010), págs. 1141-1145
-
[140]
Promoción de la administración de nanopartículas a dos poblaciones de células madre de cáncer gástrico mediante anticuerpos CD133 y CD44Farmacoterapia biomédica. 115 (2019), Artículo 108857
-
[141]
Microcápsulas de óxido de hierro y PLGA superparamagnéticas para imágenes de ultrasonidos/resonancia magnética de modalidad dual y ablación de cáncer de mama con ultrasonidos enfocados de alta intensidadBiomateriales, 33 (24) (2012), págs. 5854-5864
-
[142]
Evaluación de microcápsulas compuestas de polímero y óxido de hierro superparamagnético para cirugía de cáncer con ultrasonido focalizado de alta intensidad guiada por resonancia magnéticaCáncer BMC, 14 (1) (2014), págs. 1-11
-
[143]
Síntesis de nanopartículas de óxido de hierro conjugadas con un ligando anti-EGFR teranóstico para la obtención de imágenes por resonancia magnética para el tratamiento del cáncer de hígadoJ. Drug Delivery Ciencia y tecnología, 55 (2020), Artículo 101367
-
[144]
Administración in vivo de docetaxel encapsulado en nanopartículas de sílice para el tratamiento del cáncer de hígado con baja toxicidad y alta eficaciaNano ACS, 4 (11) (2010), págs. 6874-6882
-
[145]
Nanomotor magnético similar a un estomatocitos como portador de fotosensibilizador para el tratamiento del cáncer basado en terapia fotodinámicaColoides Surf. B: Biointerfaces, 194 (2020), Artículo 111204
-
[146]
Nanopartículas magnéticas recubiertas de polifenoles para inmunoterapia/fototermia controlada espacio-temporalmente contra el cáncerJ. Control. Liberación, 326 (2020), págs. 131-139
-
[147]
Nanopartículas lipídicas sólidas para administración parenteral de fármacosAbogado de entrega de medicamentos, Rev. 56 (9) (2004), págs. 1257-1272
-
[148]
Conjugados poliméricos como nanomedicamentos anticancerígenosReverendo Nacional del Cáncer, 6 (9) (2006), págs. 688-701
-
[149]
Nanomedicamentos poliméricos para administración de fármacos guiada por imágenes y terapia combinada dirigida a tumoresNano Hoy, 5 (3) (2010), págs. 197-212
-
[150]
Polímeros en la administración de fármacos: estado del arte y tendencias futurasIng. Adv. Mater., 13 (3) (2011), págs. B61-B87
-
[151]
Nanopartículas con núcleo de corona 'Stealth' modificadas superficialmente con polietilenglicol (PEG): influencias de la corona (longitud de la cadena de PEG y densidad de superficie) y de la composición del núcleo en la captación fagocítica y la adsorción de proteínas plasmáticasColoides Surf. B: Biointerfaces, 18 (3–4) (2000), págs. 301-313
-
[152]
Nanopartículas poliméricas biocompatibles para aplicaciones de administración de fármacos en terapias contra el cáncer y trastornos neurodegenerativosJ. Func. Biomater., 10 (1) (2019), pág. 4
-
[153]
Nanopartículas magnéticas basadas en PLA armadas con polímeros sensibles al pH y al calor para quimioterapia combinada contra el cáncerJ. Drug Delivery Ciencia y tecnología, 45 (2018), págs. 240-254
-
[154]
La anhidrasa carbónica IX como diana terapéutica contra el cáncer: evaluación preclínica de un anticuerpo monoclonal internalizante dirigido al dominio catalíticoDes. Farmacéutica Curr., 16 (29) (2010), págs. 3255-3263
-
[155]
Nanopartículas magnéticas diseñadas con poli- L -lisina para la combinación de hipertermia, imágenes por resonancia magnética y detección de células cancerosasJ. Magn. Magn. Mater., 475 (2019), págs. 316-326
-
[156]
Un hidrogel magnético natural de inspiración biológica que contiene gelatina y alginato como sistema de administración de fármacos para la quimioterapia contra el cáncerInt. J. Biol. Macromol., 156 (2020), págs. 438-445
-
[157]
Un nanosistema magnético multifuncional basado en el efecto “two strikes” para la terapia anticancerígena sinérgica en el cáncer de mama triple negativoJ. Control. Liberación, 322 (2020), págs. 401-415
-
[158]
Nanopartículas magnéticas de colorante multifuncionales en el infrarrojo cercano para bioimagen y terapia del cáncerCáncer Lett., 390 (2017), págs. 168-175
-
[159]
Aplicaciones de las nanopartículas magnéticas bacterianas en la nanobiotecnologíaJ. Nanosci. Nanotecnología. 16 (3) (2016), págs. 2164-2171
-
[160]
Magnetosoma bacteriano y sus posibles aplicacionesRes. microbiológica, 203 (2017), págs. 19-28
-
[161]
Bacterias magnetotácticas como fuentes potenciales de bioproductosMar. Drogas, 13 (1) (2015), págs. 389-430
-
[162]
Aplicaciones de los magnetosomas sintetizados por bacterias magnetotácticas en medicinaFrente. Bioing. Biotecnología, 2 (2014), pág. 5
-
[163]
Terapia fototérmica dirigida magnéticamente contra el cáncer in vivo con nanopartículas magnéticas bacterianasColoides Surf. B: Biointerfaces, 172 (2018), págs. 308-314
-
[164]
Efecto sinérgico de las nanopartículas de oro y el plasma frío en el tratamiento del cáncer glioblastomaJ. Phys. D: Física Aplicada, 47 (33) (2014), Artículo 335402
-
[165]
El plasma atmosférico frío (CAP) cambia la expresión genética de moléculas clave de la maquinaria de cicatrización de heridas y mejora la cicatrización de heridas in vitro e in vivoPLoS Uno, 8 (11) (2013), Artículo e79325
-
[166]
Esterilización de bacterias, levaduras y endosporas bacterianas mediante plasma frío a presión atmosférica utilizando helio y oxígenoJ. Microbiología, 44 (3) (2006), págs. 269-275
-
[167]
Mecanismo de coagulación sanguínea por descarga de plasma de barrera dieléctrica de presión atmosférica no térmicaIEEE Trans. Ciencias del plasma, 35 (5) (2007), págs. 1559-1566
-
[168]
Un nuevo método de blanqueamiento dental que utiliza un microchorro de plasma frío impulsado por corriente continua en aire a presión atmosféricaIEEE Trans. Ciencias del plasma, 38 (11) (2010), págs. 3143-3151
-
[169]
Demostración in vitro de las propiedades inhibidoras del cáncer de la interfaz plasma-líquido autoorganizada estratificadaRepresentante científico, 7 (1) (2017), págs. 1-11
-
[170]
Evaluación de la tecnología de regeneración cutánea con plasma en el rejuvenecimiento facial completo de baja energíaArq. Dermatol., 143 (2) (2007), págs. 168-174
-
[171]
El efecto del ajuste de la composición del plasma frío sobre la viabilidad de las células de glioblastomaPLoS Uno, 9 (5) (2014), Artículo e98652
-
[172]
Plasma atmosférico frío y nanopartículas magnéticas basadas en óxido de hierro para una terapia sinérgica contra el cáncer de pulmónRadic. libre. Biol. Med., 130 (2019), págs. 71-81
-
[173]
Hipertermia fotónica/magnética: terapia nanocatalítica sinérgica contra el cáncer gracias a nanocatalizadores de hierro de valencia ceroBiomateriales, 219 (2019), Artículo 119374