Introducción
Los campos magnéticos de baja frecuencia ejercen efectos no invasivos, no ionizantes y no térmicos sobre las células y los tejidos. Mejoran la respuesta al estrés oxidativo celular y regulan la vía de señalización apoptótica, modificando el Ca 2+ intracelular. concentración para inducir la apoptosis 1 , 2 , 3 . Se utilizan ampliamente para tratar tumores y enfermedades neuropsiquiátricas y óseas. Estudios in vivo en este campo han demostrado que los campos magnéticos de baja frecuencia inhiben la proliferación de células tumorales y prolongan su supervivencia 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 .
En la mayoría de los informes sobre el uso de campos magnéticos como terapia combinada, los campos magnéticos de frecuencia extremadamente baja mejoran la eficacia de los fármacos antitumorales 12 , 13 , 14 , 15 . Una combinación de un campo magnético de frecuencia extremadamente baja con paclitaxel en el tratamiento del cáncer de ratón reveló que el campo magnético aumentó la letalidad de ejecución del paclitaxel 16 . La permeabilidad de la membrana celular se alteró y el efecto terapéutico del cisplatino se mejoró significativamente con un campo magnético de frecuencia extremadamente baja de 10 mT combinado con cisplatino 17 . Sin embargo, Gellrich descubrió que el campo magnético de baja frecuencia no podía mejorar el efecto terapéutico del cetuximab, lo que podría estar relacionado con el cambio conformacional en el receptor de superficie molecular 18 .
En la mayoría de los experimentos in vitro, el campo magnético de baja frecuencia mostró un efecto inhibidor significativo sobre las células tumorales 2 , 3 , 19 , 20 , 21 , 22 , 23 y no afectó el crecimiento de células normales 2 , 24 . Un informe encontró que el campo magnético afectó la superficie de la membrana tumoral, influyendo así en la proliferación tumoral 25 . Sin embargo, algunos informes mostraron que la proliferación de células tumorales aumentó ligeramente bajo el campo magnético de baja frecuencia 26 .
En la actualidad, se cree que los campos magnéticos pueden inhibir significativamente el crecimiento tumoral, y el efecto inhibidor tiene una correlación positiva con el tiempo y la intensidad. Mientras tanto, la producción de especies reactivas de oxígeno (ROS) es un fenómeno inevitable que se considera la clave del efecto inhibidor del campo magnético 3 . Sin embargo, el mecanismo exacto no está claro. En el desarrollo de terapias antineoplásicas, el efecto inhibidor del campo magnético sobre el crecimiento tumoral es un atributo significativo para el rendimiento clínico de muchas tecnologías existentes.
Se han realizado muchos experimentos sobre las diferencias en los ajustes del campo magnético, pero se ha investigado poco sobre el efecto de la diferencia en el campo magnético en el entorno tumoral y el posible mecanismo de inhibición, excepto las ROS. En este estudio basado en el efecto de un campo magnético en el entorno intercelular y la estructura intercelular (la forma de contacto natural entre células y la forma de interferencia humana), las células se cultivaron in vitro. El estudio encontró que el estado de agregación intercelular era un fenómeno necesario para la inhibición magnética. Al mismo tiempo, durante la proliferación celular, se liberaron uno o varios sustratos relacionados en el medio acondicionado, que podrían actuar junto con el campo magnético para lograr el efecto de inhibición del campo magnético.
En este experimento, se utilizó un campo magnético de 5 mT y 20 Hz como único fondo. En experimentos anteriores, la intensidad del campo magnético no era fija y, a menudo, no entraba en contacto directo con las células o no se podía colocar en una incubadora. El generador de campo magnético simple diseñado en este estudio podía estar en contacto directo con las células y colocarse en una incubadora en condiciones estables de temperatura y CO 2 . Nuestro generador de campo magnético también tenía desventajas, es decir, cuando se generaba un campo magnético, también generaba calor. Basado en el diseño de intensidad de Crocetti 19 , se diseñó un generador de campo magnético para estabilizar el calor a través de la disipación de calor.
Resultados
El campo magnético inhibió las células tumorales adherentes, lo que fue influenciado por la diferencia en el entorno de cultivo (medio acondicionado).
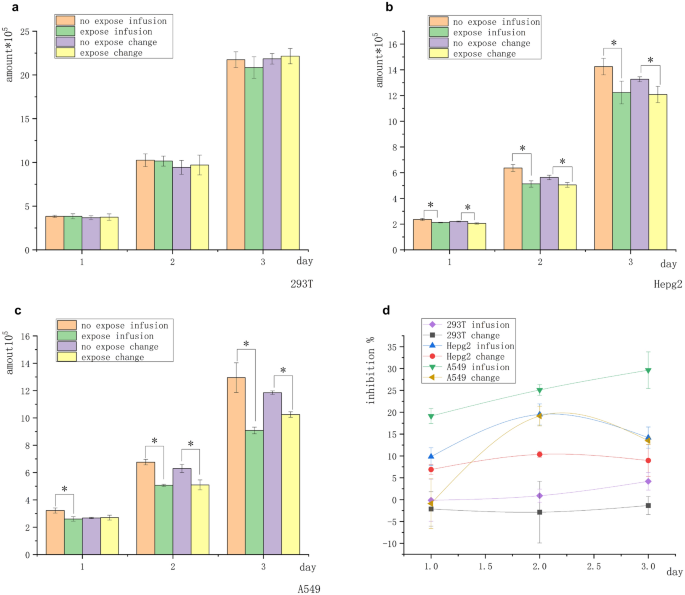
Los grupos de tratamiento se dividieron en dos grupos antes de la exposición. Grupo de infusión: antes de la exposición diaria, se añadieron lentamente 500 µL del medio fresco con una pipeta a la pared del poro. El medio de cultivo acondicionado era una mezcla de varias sustancias (medio incubado durante la noche después del pase y la laminación) y un medio fresco para el crecimiento exponencial. Grupo de cambio: antes de la exposición diaria, se aplicó una pipeta a la pared del poro para eliminar la mayor parte del medio (casi todo), que se reemplazó con un medio del mismo volumen que el grupo de “infusión”. El medio acondicionado era completamente fresco sin secreciones o con secreciones mínimas. La diferencia entre los dos grupos fue la composición del medio acondicionado: la composición en el “grupo de infusión” era más compleja, mientras que la composición en el “grupo de cambio” era más cercana a la del medio no utilizado. Las células epiteliales renales humanas normales 293 T, las células de cáncer de hígado humano Hepg2 y las células de cáncer de pulmón de células no pequeñas humanas A549 se procesaron de forma independiente a través de un medio de cultivo de “infusión” o “cambio” y se expusieron a la intensidad de 5-mT del campo magnético durante 2 h cada día durante un total de 3 días. El número inicial de todas las células fue de 2 × 10 5 . La Figura 1 a muestra que la línea celular no tumoral 293 T no fue inhibida por el campo magnético en el “grupo de infusión” y el “grupo de cambio”. Las Figuras 1 b y c muestran que el número de células Hepg2 y A549 expuestas al campo magnético fue significativamente menor que el de las células en el grupo de control no expuesto. Ambas líneas de células tumorales Hepg2 y A549 fueron inhibidas por el campo magnético (la tasa de inhibición más alta de Hepg2 fue de aproximadamente el 18%, y la de A549 fue de aproximadamente el 30%). Las células tumorales del “grupo de infusión” mostraron inhibición el día 1, mientras que las células del “grupo de cambio” no mostraron inhibición significativa. La tendencia de inhibición en el “grupo de infusión” fue significativamente más fuerte que en el “grupo de cambio”. El efecto inhibidor en el “grupo de infusión” (A549) se correlacionó positivamente con la duración de la exposición (Fig. 1 d). Estos resultados indicaron que las células tumorales eran más sensibles al campo magnético en el medio acondicionado (microambiente) modificado por señales autocrinas y paracrinas.
La diferencia en el entorno (medio acondicionado) antes de la exposición afectó el efecto inhibidor del campo magnético sobre las células adherentes. ( a ) No se encontró diferencia significativa en el número de 293 células T en 3 días. ( b ) El número de células Hepg2 en los grupos no expuestos y expuestos fue significativamente diferente. ( c ) El número de células A549 en los grupos no expuestos y expuestos fue significativamente diferente. ( d ) Curva de inhibición celular. La tasa de inhibición celular en el grupo de infusión fue más obvia que en el grupo de cambio, y la tasa de inhibición celular normal no fue de significancia estadística ( * P < 0,05, frente al grupo de control sin exposición).
Se destruyó la agregación espontánea de células tumorales suspendidas y desapareció la inhibición magnética.
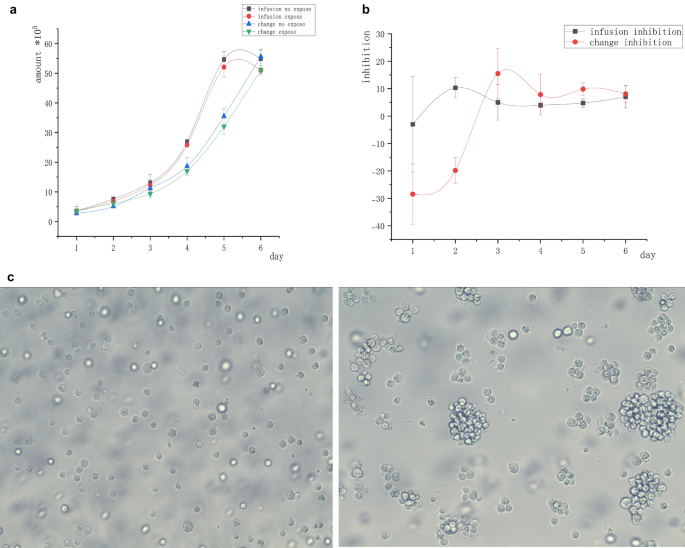
Investigamos si una pérdida de nutrientes en el medio acondicionado, una densidad celular excesiva y la interferencia con la inhibición del campo magnético por tripsina podrían afectar la mayor duración de la inhibición magnética. En particular, realizamos el experimento utilizando células Raji de linfoma suspendidas. En cultivo natural, las células suspendidas se reunieron espontáneamente en grupos. La estructura de dichos grupos se destruyó inevitablemente cuando las células centrifugadas se reemplazaron con un medio acondicionado en el grupo de cambio. También destruimos la estructura del grupo en el grupo de infusión para asegurar la consistencia de las condiciones experimentales. Las células suspendidas se infundieron o cambiaron con el medio de cultivo y se expusieron a un campo magnético de 5 mT durante 2 h diarias durante 6 días. Grupo de infusión: antes de la exposición diaria, se agregaron lentamente 500 µL del medio fresco con una pipeta a la pared del poro y las células se soplaron con una pistola de pipeta para separarlas en suspensión y destruir la estructura aglomerativa. Grupo de cambio: Antes de la exposición diaria, la suspensión celular se aspiró y se centrifugó a 1200 rpm para eliminar el sobrenadante, que luego se reemplazó con un medio del mismo volumen que el grupo de “infusión”. El día 3, el medio acondicionado se reemplazó por completo en el grupo de infusión, mientras se transferían las células de ambos grupos a recipientes más grandes. Las células tumorales suspendidas se cultivaron in vitro sin tripsina y se transfirieron fácilmente a recipientes más grandes, evitando el daño por tripsina. En tales condiciones, ninguno de los grupos mostró una inhibición significativa en comparación con el grupo de control sin exposición.
El número inicial de todas las células fue de 2 × 10 5 . La figura 2a no muestra ninguna diferencia significativa en el número de células en el “grupo de infusión” y el “grupo de cambio” después de 6 días de exposición al campo magnético en comparación con el grupo de control sin exposición. La figura 2b muestra que la inhibición del campo magnético no fue obvia después de que desapareció la estructura de agregación.
Curva de crecimiento celular de células tumorales Raji suspendidas libremente en los grupos de infusión y de cambio. ( a ) Curvas de inhibición celular bajo diferentes grados de frescura del medio de cultivo. Bajo la condición de dispersión celular, no se encontró diferencia significativa entre el número de células expuestas al campo magnético y las del grupo de control no expuesto. ( b) Curvas de tasa de inhibición bajo la condición de dispersión celular; las células tumorales no fueron inhibidas por la exposición al campo magnético bajo diferentes grados de frescura del medio de cultivo. ( c ) Agrupamiento celular espontáneo (derecha) y separación artificial (izquierda).
Como se muestra en la figura 2a , el número de células en el “grupo de infusión” fue significativamente mayor que en el “grupo de cambio” el día 4 (después de reemplazar el recipiente grande). El entorno del “grupo de infusión” fue más adecuado para el crecimiento de células tumorales suspendidas.
La figura 2c muestra células suspendidas en estados separados y naturales. Se observó que la mayoría de las células eran unicelulares en lugar de agrupaciones multicelulares después de la destrucción de la estructura de agrupación.
Se mantuvo la agregación espontánea de células tumorales suspendidas y apareció inhibición magnética.
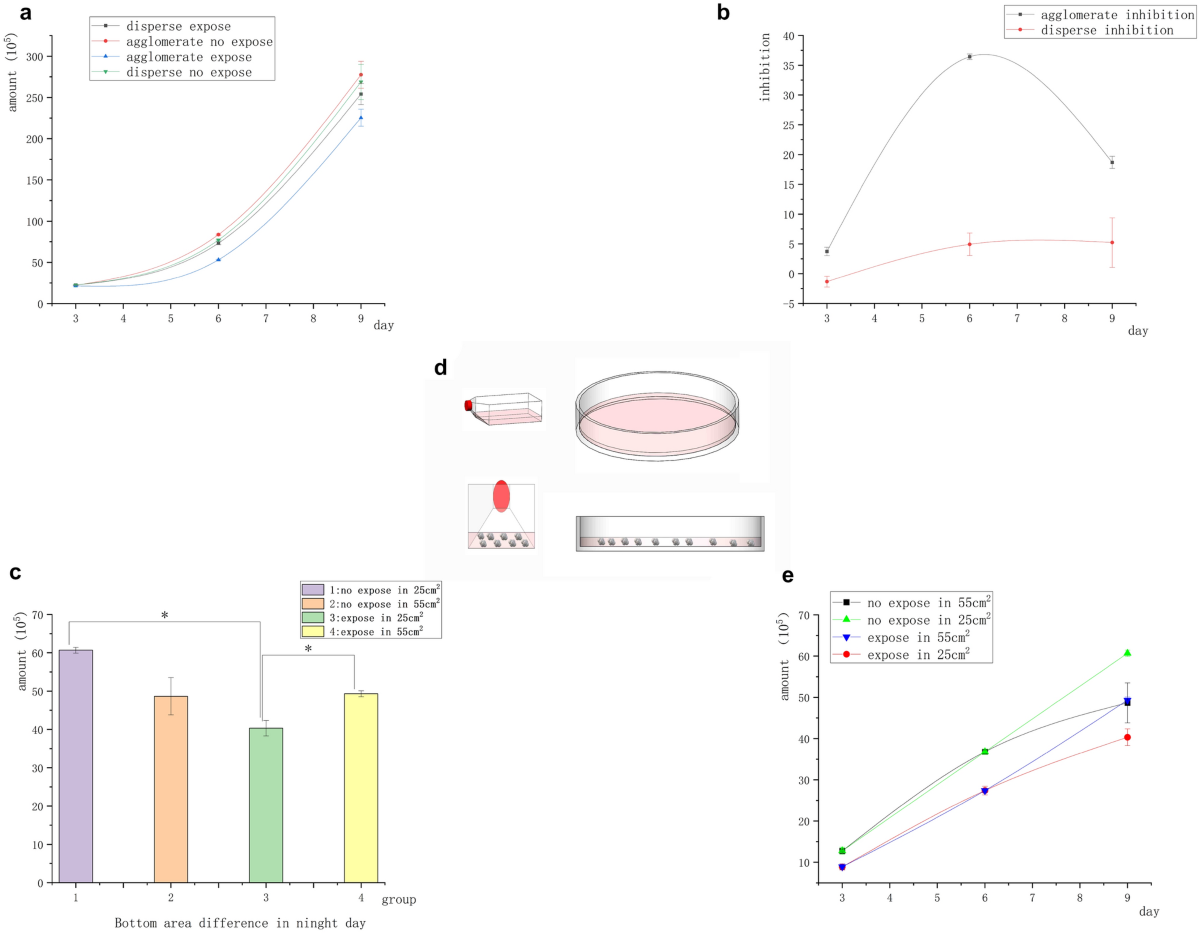
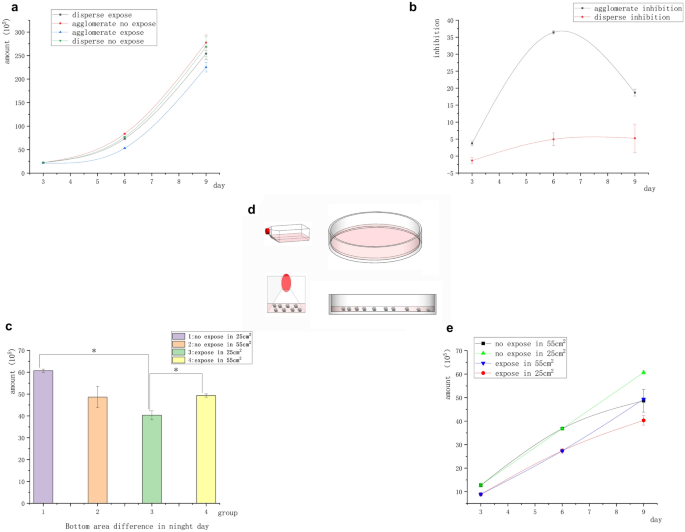
En el experimento anterior sobre células de linfoma de Raji, se destruyó la agregación espontánea de células tumorales suspendidas y desapareció la inhibición magnética. Demostramos que el campo magnético no ejercía ningún efecto inhibidor sobre las células cancerosas suspendidas libremente. En este grupo de experimentos, examinamos si el contacto celular desempeñaba un papel en el efecto de la inhibición magnética sobre el crecimiento tumoral. Se estudiaron células Raji agregadas en grupos en un experimento de exposición continua de 9 días. Las células se transfirieron a un recipiente más grande, mientras que el medio de cultivo se cambió cada 3 días. Grupo "Aglomerado": No se realizó ningún procedimiento excepto el reemplazo del medio cada 3 días y la transferencia a recipientes más grandes. Grupo "Disperso": Antes de la exposición diaria, las células se soplaron con una pistola de pipetas para separar las células en suspensión y destruir la estructura aglomerativa.
El número inicial de todas las células fue de 2 × 10 5 . La figura 3a muestra que el número de células Raji bajo agregación en suspensión en el campo magnético fue significativamente menor que en el grupo de control no expuesto, mientras que el número de células Raji bajo separación en suspensión en el campo magnético no mostró diferencias significativas en comparación con el control no expuesto. La figura 3b muestra la diferencia en la tasa de inhibición del campo magnético entre los dos grupos de células (agregación en suspensión y separación en suspensión). Indicó que las células Raji fueron inhibidas por el campo magnético bajo la condición de agregación en suspensión. Mientras tanto, las células Raji no fueron inhibidas por el campo magnético bajo la condición de separación en suspensión. Las células Raji fueron menos sensibles a la inhibición magnética que las células adherentes, y la tasa de inhibición de las células Raji en el día 6 fue similar a la de las células A549 en el día 3. En ausencia del campo magnético, el número de células Raji en el grupo de agregación suspendida fue significativamente mayor que en el grupo de separación suspendida. Por el contrario, en la exposición al campo magnético, el número de células Raji en el grupo de separación suspendida fue significativamente mayor que en el grupo de agregación suspendida. Sin embargo, el día 9, la inhibición magnética disminuyó o desapareció. Repetimos el experimento para determinar las razones de la desaparición de la tasa de inhibición el día 9. Tomamos el área en el fondo del recipiente como control para investigar si las diferencias en la densidad del grupo de células causaron la reducción de la inhibición magnética (menor contacto entre células), y expusimos las células en el estado agrupado a un campo magnético de 5 mT, 20 Hz durante 9 días. El medio acondicionado se cambió cada 3 días y se reemplazó el recipiente grande. La operación se mantuvo sin cambios durante los primeros 6 días. El sexto día de transferencia, las células se dividieron en recipientes con diferentes tamaños de base [placa Petri de 10 cm (55 cm 2 ) y placa Petri de 25 cm 2 matraz de cultivo]. El único cambio fue que las células se transfirieron el día 6, utilizando la placa Petri de 10 cm (55 cm 2 ) y 25 cm 2 matraz (en diferentes áreas basales, las masas celulares estaban más concentradas) como controles. Sorprendentemente, la tasa de inhibición de las células Raji en el matraz de 25 cm 2 El matraz alcanzó un 36 % el día 9. La inhibición de las células Raji en la placa Petri de 10 cm (55 cm 2 ) desapareció el día 9 (Fig. 3 c). Los resultados fueron consistentes con los hallazgos anteriores. La razón de este resultado debería estar relacionada con la proximidad de las células (Fig. 3 d).
Inhibición aglomerada y dispersa de células tumorales Raji suspendidas. ( a ) La curva de crecimiento de células suspendidas con diferentes estructuras de contacto mostró que el número de células en el grupo expuesto al campo magnético fue significativamente diferente al del grupo no expuesto al campo magnético bajo la condición de agregación celular. Sin embargo, no se encontró diferencia significativa entre el grupo expuesto al campo magnético y el grupo no expuesto al campo magnético bajo la condición de dispersión celular. ( b ) Curva de inhibición de diferencia de estructura: Las células agrupadas tuvieron inhibición significativa, pero las células dispersas no tuvieron inhibición. ( c ) El día 9, bajo el mismo volumen y diferentes áreas basales, el número de células en el grupo con áreas basales más pequeñas se redujo significativamente ( * P < 0,05, frente al grupo de control sin exposición; * P < 0,05, vs el grupo con diferente área de botella) ( d ) Como se muestra en la figura, las células se agruparon más estrechamente en el matraz de cultivo, mientras que las células en la placa de Petri se dispersaron en el fondo debido al bajo nivel de líquido. ( e ) Curva de crecimiento diferencial de la zona inferior del recipiente de cultivo en el día 9.
El potencial de membrana se relacionó con la inhibición del campo magnético.
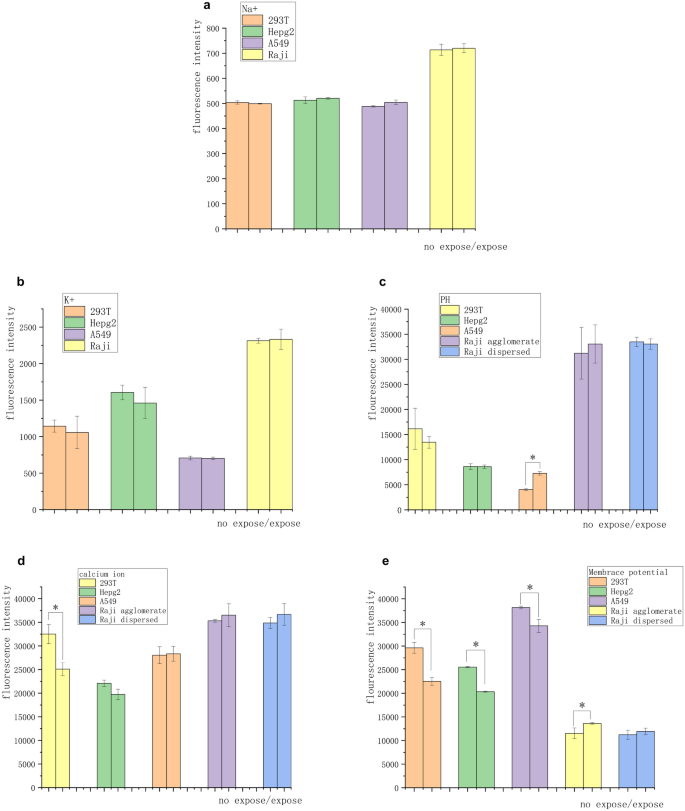
Los experimentos en células tumorales suspendidas mostraron que el efecto inhibidor del campo magnético sobre las células cancerosas se logró a través del contacto y la comunicación entre células, lo que tuvo implicaciones para la transmisión de señales entre células y los cambios iónicos en el microambiente celular. Se utilizaron kits de calcio, sodio, potasio y pH Calbryte 520 AM, SBFI AM, PBFI AM y BCECF AM para observar los cambios en los iones libres intracelulares de cuatro tipos de células después de 3 días de exposición magnética con el fin de investigar si la supresión del campo magnético estaba asociada con la señalización iónica. No se observaron cambios en las concentraciones intracelulares de iones de sodio y potasio en células normales o tumorales (Fig. 4 a y b). Además, no se encontró ninguna diferencia significativa en la intensidad de la fluorescencia del pH en todos los grupos de células excepto A549 (Fig. 4 c). Las células 293 T normales mostraron una disminución significativa en la concentración intracelular de iones de calcio libre. Las células tumorales sólidas no mostraron ningún cambio significativo, mientras que las células tumorales suspendidas mostraron un ligero aumento en la concentración de iones de calcio (Fig. 4 d).
Diferencias en la fuerza iónica y el potencial de membrana de las células expuestas a un campo magnético de 5 mT y 20 Hz durante 3 días. ( a ) No se encontraron diferencias significativas en la intensidad de fluorescencia de los iones de sodio después de 3 días de exposición. ( b ) No se encontraron diferencias significativas en la intensidad de fluorescencia de los iones de potasio después de la exposición a los iones de sodio durante 3 días. ( c) Después de 3 días de exposición, no se encontró diferencia significativa en la intensidad de fluorescencia en todos los grupos de células excepto A549. ( d ) La concentración de iones de calcio en las células 293 T disminuyó, mientras que no se observó diferencia significativa en la concentración de iones de calcio en los otros grupos. ( e ) Las células adherentes mostraron hiperpolarización significativa, los aglomerados de células tumorales mostraron despolarización significativa y las células tumorales suspendidas libremente no mostraron despolarización significativa. Estos cambios correspondieron a los cambios en las concentraciones intracelulares de iones de calcio ( * P < 0,05, frente al grupo de control sin exposición).
Un cambio en la concentración iónica de calcio se refleja generalmente en un cambio en el potencial de membrana. Se utilizó el kit de potencial de membrana DiBAC4 (3) para observar las células expuestas el día 3 con ΔIIF correspondiente a la proporción de la fluorescencia iónica intracelular para el día 3 e inicialmente. Las células adherentes mostraron una hiperpolarización significativa (ΔIIF células 293 T: − 25%, ΔIIF células Hepg2: − 20% y ΔIIF células A549: − 13%). Los aglomerados de células tumorales mostraron una despolarización significativa (ΔIIF células Raji: + 9%). Las células tumorales suspendidas libres no mostraron una despolarización significativa (Fig. 4 e). Las figuras S1–S3 muestran datos de citometría de flujo.
Las células secretaron sustancias en el medio acondicionado, que interactuaron con el campo magnético para inhibir las células tumorales; la sustancia tenía una expresión universal y era específica del tumor.
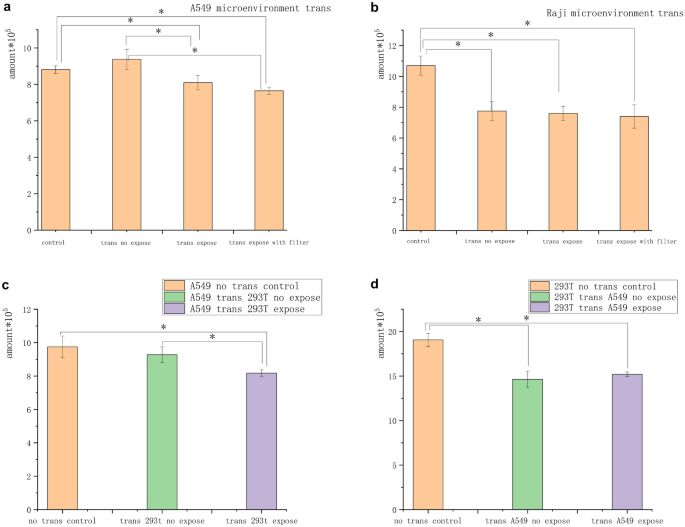
Las células A549 y Raji en aglomerados se expusieron independientemente al campo magnético de 5 mT durante 3 h para determinar si la inhibición del campo magnético estaba relacionada con un cambio en el medio acondicionado en el estado de agregación celular. Luego, el medio acondicionado se transfirió para alimentar células no expuestas de la misma especie durante 2 días. El número de células en el grupo de "transferencia" A549 fue de 4 × 10 5 . El número de células en el grupo de "transferencia" Raji fue de 8 × 10 5 . El número de células en el grupo de "transferencia" A549 fue de 2 × 10 5 . El número de células en el grupo de "transferencia" Raji fue de 4 × 10 5 . En estas condiciones, las células del grupo de "transferencia" A549 se inhibieron significativamente a una tasa de aproximadamente el 10 %, que fue casi la mitad de la de las células con exposición directa el día 1 en el grupo de infusión de líquido. Las células del grupo “transferido” de Raji no mostraron inhibición, pero las células de los grupos de transferencia fueron inhibidas en comparación con las del grupo de control no expuesto (Fig. 5 a y b).
El medio acondicionado inhibió el crecimiento de células tumorales. ( a ) Después de que las células A549 se expusieron al campo magnético, el medio acondicionado se filtró y se reemplazó con el medio acondicionado no expuesto. El medio acondicionado A549 expuesto tuvo un efecto inhibidor sobre las células A549 no expuestas. ( b ) Después de que las células Raji se expusieron al campo magnético, el medio acondicionado se filtró y se reemplazó con el medio acondicionado no expuesto. No se encontró diferencia en el número de células entre los grupos de cambio, pero el número de células en el grupo de cambio fue significativamente menor que en el grupo de control no tratado. ( c ) El número de células A549 transferidas desde el medio acondicionado de células 293 T expuestas se redujo significativamente en comparación con el del control no tratado y el medio acondicionado no expuesto. ( d ) No se encontró diferencia significativa en el número de células T 293 en el medio acondicionado de células A549 después de la exposición en comparación con el de los grupos no tratados y no expuestos ( * P < 0,05, frente al grupo de control sin exposición; * P < 0,05, frente al grupo de control sin transferencia).
Además, las células A549 y 293 T se expusieron al campo magnético de 5 mT durante 3 h para determinar si este medio acondicionado era exclusivo de las células tumorales e inhibía a las células normales. A continuación, los medios de cultivo expuestos se transfirieron para alimentar a las células no expuestas de las diferentes especies durante 2 días. Los resultados mostraron que las células A549 se inhibieron significativamente en los medios de cultivo 293 T. Las células del grupo de transferencia 293 T no mostraron inhibición, pero las células de todos los grupos de transferencia se inhibieron en comparación con las del grupo de control no expuesto (Fig. 5 c y d).
Discusión
La exposición al campo magnético tiene el potencial de servir como una estrategia avanzada en el tratamiento del cáncer. Las ROS producidas por las células que utilizan este método parecen ser la clave para la inhibición del crecimiento tumoral 3 . Demostramos que el mecanismo principal no solo estaba relacionado con las ROS, sino que también estaba estrechamente relacionado con el contacto entre las células. Especulamos que la exposición al campo magnético cambió la secreción de ciertos sustratos, lo que llevó a los cambios en la señalización y, por lo tanto, restableció la inhibición del contacto con las células tumorales. Con base en los resultados experimentales y los experimentos previos, se resumieron cuatro propiedades de la supresión del campo magnético.
-
1.
Los experimentos sobre la inhibición del campo magnético de las células, especialmente de las células Raji, demostraron que el contacto estrecho entre las células determinaba directamente si existía el efecto de inhibición. Como se muestra en las figuras 2a , 3a y c, la agregación suspendida aceleró el crecimiento de las células tumorales suspendidas, mientras que la exposición al campo magnético inhibió el crecimiento de las células tumorales. Como se muestra en la Fig. 3c , la tasa de inhibición del campo magnético varió el día 9 dependiendo del área del fondo del recipiente. El número de células expuestas agrupadas en un área de 55 cm2 fue significativamente mayor que en un área de 25 cm 2 , pero no se encontró una diferencia significativa entre el número de células expuestas agrupadas y las del grupo de control no expuesto. Durante este período, la inhibición de las células tumorales suspendidas desapareció, lo que indica que la distancia entre los grupos de células se expandió y el crecimiento celular se aceleró. Por el contrario, en el área de 25 cm 2 En el matraz de cultivo, la diferencia en el número de células entre los grupos expuestos y de control aumentó significativamente, es decir, la tasa de inhibición aumentó. Esto indicó que las células tumorales recuperaron la inhibición de contacto bajo la exposición al campo magnético. Por lo tanto, la inhibición del campo magnético requirió un contacto cercano entre las células.
-
2.
El experimento con células adherentes mostró que las células tumorales eran más susceptibles a la inhibición magnética utilizando medios acondicionados más adecuados para el crecimiento celular. Como se muestra en la Fig. 1 b y c, el número de células tumorales en el medio acondicionado del grupo de control no expuesto fue significativamente mayor que en el medio fresco, mientras que el número de células tumorales en el medio acondicionado del grupo expuesto fue significativamente menor que en el medio fresco (el efecto de inhibición magnética fue significativamente mayor en el grupo de infusión que en el grupo de cambio). Se sugirió que el medio acondicionado era adecuado no solo para el crecimiento exponencial de células en ausencia del campo magnético sino también para la comunicación entre células, lo que aumentó el efecto de inhibición por contacto bajo el campo magnético. Por lo tanto, la tasa de inhibición del campo magnético dependía de la estabilidad del entorno para extender la inhibición por contacto.
-
3.
Determinamos que ciertos sustratos en los medios acondicionados también contribuyeron a la inhibición magnética. La inhibición se observó cuando el medio acondicionado del grupo de infusión (A549) se transfirió a células no expuestas después de la exposición al campo magnético, lo que demuestra la presencia de señales de inhibición en el medio. Las células tumorales suspendidas fueron menos sensibles a la inhibición magnética en comparación con las células tumorales adherentes. Además, la agregación celular se vio afectada inevitablemente durante la transferencia de los medios acondicionados. Por lo tanto, se requirió más diseño y consideración para la transferencia de células tumorales en medios condicionales de suspensión.
En un estudio de células xenogénicas en el que se intercambiaron los medios acondicionados de células normales 293 T y células tumorales A549 y se transfirieron a células no expuestas después de la exposición al campo magnético, las células tumorales mostraron inhibición mientras que las células normales no mostraron inhibición significativa. Indicó que ciertos sustratos que interactúan con el campo magnético eran ubicuos en células sensibles a las células tumorales. La Figura 5 c y d indica que estos sustratos también existían en células no tumorales y no inhibían el crecimiento de células no tumorales. Se especuló que la capacidad de inhibición por contacto de las células no tumorales no se silenció y, por lo tanto, el crecimiento de células no tumorales no se inhibió por estas sustancias. El número de células de control sin transferencia fue mayor que en el grupo de transferencia, posiblemente porque el medio acondicionado A549 no era adecuado para el crecimiento de células no tumorales. Con base en los resultados de la inhibición magnética reducida después de la dispersión de células en suspensión o la separación de grupos, se especuló que los sustratos podrían estar relacionados con la comunicación intercelular y la inhibición por contacto celular. La señal intercelular aumentó y la inhibición por contacto desapareció cuando las células se suspendieron y se separaron o los grupos estaban demasiado separados. Por lo tanto, las células secretaron uno o más sustratos y los campos magnéticos de baja frecuencia interactuaron con las células y los sustratos para inhibir específicamente las células tumorales.
La relación entre las sustancias relevantes, los medios acondicionados y la inhibición por contacto necesita mayor verificación experimental.
-
4.
Nuestros experimentos in vitro de campo magnético de baja frecuencia tuvieron un punto en común: la eficiencia de inhibición magnética aumentó con el aumento del tiempo de exposición cuando las células se agruparon y el entorno de cultivo fue estable (medio acondicionado del grupo de infusión), lo que fue consistente con la mayoría de los informes actuales. Mientras tanto, la mayoría de los informes también sugirieron que la intensidad del campo magnético se correlacionó positivamente con la eficiencia magnética. Por lo tanto, la eficiencia de supresión magnética se correlacionó positivamente con el tiempo de exposición de la intensidad del campo magnético 2 , 3 , 19 , 20 .
Para la exposición al campo de baja frecuencia, la tinción con azul tripán no reveló tinción celular obvia ni diferencia significativa en la actividad celular, lo que podría estar relacionado con el hecho de que no se observó muerte celular debido a la tinción directa después del tratamiento. Indicó que el campo magnético no mató directamente las células, sino que indujo continuamente la apoptosis; por lo tanto, las células no se tiñeron con azul tripán. Otros informes mostraron que la actividad intracelular de la caspasa-3 se reguló positivamente y la integridad de la membrana disminuyó después de la exposición al campo magnético 2 , 3 . Algunos informes revelaron que algunas células tumorales tenían eficiencia de tinción 19 , lo que podría estar relacionado con el tipo de célula y la selección del tiempo de detección. La tinción con anexina V también mostró una inhibición magnética progresiva. Sin embargo, el efecto varió según el tipo de célula 2 .
El efecto específico de los campos magnéticos sobre la señalización en el entorno celular aún no está claro. La vía de señalización implicada en el campo magnético puede estar relacionada con la inhibición de contacto y la herencia epigenética. Impulsados por las señales celulares 1 , 22 , 27 , 28 , 29 , presumimos la presencia de señales eléctricas entre las células y los iones de calcio, que son el segundo mensajero asociado con la división celular. Varios experimentos con sondas fluorescentes mostraron que el cambio en el potencial de membrana estaba relacionado con la exposición al campo magnético, y la reacción del potencial de membrana era diferente entre las células adherentes y suspendidas. El potencial de membrana de las células adherentes tendía a hiperpolarizarse bajo el campo magnético. El potencial de membrana de las células tumorales suspendidas agrupadas tendía a despolarizarse bajo el campo magnético. Esto podría estar relacionado con el crecimiento celular y la respuesta de comunicación intercelular asociada bajo el campo magnético. Como se muestra en la Fig. 3 c y e, las células Raji suspendidas y aisladas crecieron más rápido bajo el campo magnético. Los hallazgos del equipo de Yong Zhou 27 explicó este fenómeno. La tasa de crecimiento celular aumentó durante la despolarización, lo que implicó la nanoagregación de interruptores k-Ras en la superficie de la membrana. Las células tumorales suspendidas se dispersaron entre sí, la señalización intercelular de ciertas sustancias aumentó y la inhibición del contacto celular inducida por el campo magnético desapareció. Mientras tanto, el potencial de membrana celular de las células tumorales suspendidas se despolarizó, lo que aceleró el crecimiento celular, y la inhibición disminuyó o desapareció. La señal de calcio intracelular y el potencial de membrana con el cambio en el campo magnético estaban relativamente sincronizados (excepto A549). Planteamos la hipótesis de que la concentración de iones de calcio estaba asociada con el potencial de membrana en la exposición al campo magnético. Además, solo 293 células T mostraron diferencias significativas en la concentración de iones de calcio cuando se expusieron al campo magnético. Esto posiblemente estuvo relacionado con la hipermetilación de la red de señalización de calcio asociada al tumor 30 . En la actualidad, la relación entre la concentración de iones de calcio y el potencial de membrana y la señal de inhibición del campo magnético no está clara. Además, el pH intracelular de las células A549 aumentó bajo el campo magnético. Esto podría estar relacionado con el hecho de que las células A549 eran más sensibles al campo magnético. También podría ser esta la razón por la que el cambio de calcio en las células A549 no estaba sincronizado con el potencial de membrana.
Este estudio tuvo ciertas limitaciones. En los experimentos con células tumorales suspendidas, utilizamos una pipeta para destruir la estructura del grupo y no pudimos mantener las células separadas todo el tiempo durante la exposición al campo magnético. Además, no pudimos mantener la agregación celular durante la transferencia a contenedores más grandes cada 3 días. En la detección de iones y potencial de membrana, sabíamos que el potencial de membrana estaba relacionado con la exposición al campo magnético. Sin embargo, el kit solo podía medir el estado de un cierto período y, por lo tanto, se necesita una detección sincrónica en tiempo real para aclarar la relación específica. Además, los cambios en el potencial de membrana también indicaron los cambios en las señales intracelulares. Por lo tanto, se especuló que el potencial de membrana podría usarse como medio para verificar el efecto inhibidor del campo magnético sobre las células tumorales.
La combinación de las cuatro propiedades clave mencionadas anteriormente del efecto inhibidor del campo magnético sobre las células podría servir como una buena modalidad anticancerígena adyuvante. En la actualidad, la terapia con campos magnéticos ha ganado cada vez más atención. Además, la universalidad de las señales celulares con la exposición al campo magnético y el amplio espectro de tumores la convierten en una excelente metodología para el tratamiento y el pronóstico. Nuestros hallazgos, junto con otros informes, revelaron aún más el potencial de la terapia con campos magnéticos. Nuestro próximo estudio se centrará en los mecanismos involucrados en los campos magnéticos, comenzando con los sustratos.
Métodos
Kit de prueba
Se adquirió un kit de sonda de calcio Calbryte 520 AM (artículo n.º 20650) de AATBioquest (EE. UU.). También se adquirió de AATBioquest un tampón de Hanks con 20 mM de HEPES (artículo n.º 20011) y una sonda fluorescente de potencial de membrana DiBAC4 (3) (artículo n.º 21411). Se adquirió una sonda fluorescente de iones de sodio SBFI (artículo n.º 18764) de Cayman Company (EE. UU.). Se adquirió una sonda fluorescente de iones de potasio PBFI (artículo n.º 21602) de Cayman Company. Se adquirió Pluronic F-127 (ST501-10G) de Beyotime Biotechnology.
Cultivo celular
Se obtuvieron células 293 T, células Hepg2 y células A549 del Banco de células de la Academia China de Ciencias (Shanghái, China). Las líneas celulares se cultivaron en DMEM (Biological Industries, Israel) con 10 % de suero bovino fetal (FBS, ExCell Bio, China) y 1 % de penicilina-estreptomicina (P/S, Industries, Israel). Las células se incubaron a 37 °C en presencia de 5 % de CO2 . Todas las operaciones se llevaron a cabo dentro de la mesa de trabajo limpia de flujo vertical.
Las células Raji se cultivaron en el medio RPMI1640 (Biological Industries) con 10 % de FBS y 1 % de P/S. Las células se incubaron a 37 °C en presencia de 5 % de CO2 . Todas las operaciones se llevaron a cabo dentro de la mesa de lavado de flujo vertical.
Exposición y características del campo magnético
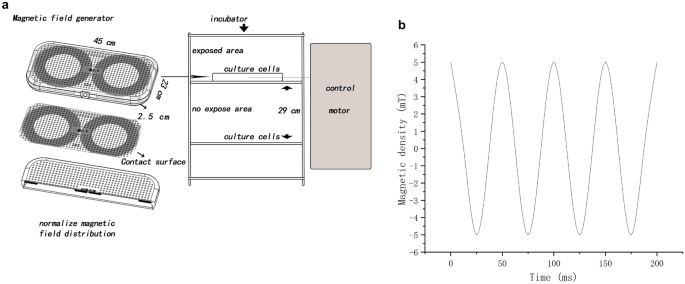
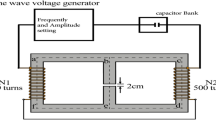
El generador de campo magnético de fabricación propia convirtió las señales eléctricas en señales de campo magnético a través de un cable de cobre esmaltado (Fig. 6 , Fig. S4). La carcasa estaba hecha de material plástico de acrilonitrilo butadieno estireno con especificaciones: 450 × 230 × 25 (L × P × H, mm 3 ). La salida del campo magnético se podía cambiar ajustando la frecuencia y la amplitud del voltaje de la fuente de alimentación del equipo al dispositivo generador de campo magnético. El dispositivo generador de campo magnético se colocó en una incubadora y el campo magnético se midió con un medidor de Gauss (TES 1393; TES Electrical Electronic Corp, Taiwán). Las células del grupo no expuesto se colocaron en la misma incubadora (Thermo Scientific, EE. UU.). La dirección del campo magnético era perpendicular al generador de campo magnético. Durante todo el experimento, la intensidad del campo magnético parásito en cada incubadora fue inferior a 0,02 mT (0–0,02 mT) y la temperatura se ajustó a 37 ± 0,18 °C.
Conteo de células
Células adherentes: El sobrenadante se recolectó en un tubo de centrífuga y se lavó dos veces con solución salina normal. El sobrenadante limpio se extrajo, se agregó al tubo de centrífuga y luego se digirió con tripsina (el tiempo óptimo de digestión varió de una célula a otra: 293 T, 1 min; Hepg2, 1 min; A549, 2 min). La digestión se terminó en el medio y todas las células se agregaron al tubo de centrífuga. Luego, el orificio se limpió con solución salina normal muchas veces y se agregó al tubo de centrífuga. En este momento, el tubo de centrífuga contenía todas las células. Si quedaban células en el orificio se observó bajo el microscopio.
Células suspendidas: todas las suspensiones celulares se colocaron en un tubo de centrífuga. Los orificios se lavaron con solución salina normal varias veces y se colocaron en el tubo de centrífuga. En ese momento, el tubo de centrífuga contenía todas las células. Se observaron los poros en busca de residuos celulares bajo el microscopio.
Recuento: Las células se centrifugaron, se resuspendieron en un medio adecuado, se diluyeron parcialmente y se tiñeron con azul tripán. Luego se inyectaron 10 µL del mismo a través del cubreobjetos.
Fórmula de cálculo: Número de células/4 × volumen × relación de dilución × 10 4 .
Las células de cada grupo se contaron tres veces para un total de tres grupos.
Detección del valor de pH
Para evaluar el valor de pH intracelular se utilizó el colorante fluorescente permeable a la membrana BCECF AM y la sonda fluorescente sensible al pH 2',7'-bis-(2-carboxietil)-5-carboxifluoresceína (Beyotime Biotechnology, China). Las células se cultivaron en placas de 96 pocillos y se expusieron a un campo magnético de 5 mT, 20 Hz durante 2 h los primeros 2 días. El día 3, las células se resuspendieron en 100 µL de 25 µM de BCECF AM en solución de trabajo Pluronic F-127 al 0,04% y se incubaron en una atmósfera de CO 2 incubadora a 37 ± 0,18 °C durante 1 h. El sobrenadante se reemplazó con tampón HHBS (AAT Bioquest, EE. UU.) y las células se expusieron a un campo magnético durante 2 h. Luego, el sobrenadante se reemplazó con PBS y los valores de pH se determinaron mediante citometría de flujo FITC (FACS Calibur, BD).
Ensayos de concentración de calcio intracelular
Se utilizó el colorante fluorescente permeable a la membrana Calbryte 520 AM (AAT Bioquest) para evaluar la concentración intracelular de calcio. Las células se cultivaron en placas de 96 pocillos y se expusieron a un campo magnético de 5 mT, 20 Hz durante 2 h los primeros 2 días. El día 3, las células se resuspendieron en 100 µL de Calbryte 520 AM 5 µM en solución de trabajo Pluronic F-127 al 0,04% y se incubaron en una atmósfera de CO 2 incubadora a 37 ± 0,18 °C durante 1 h. El sobrenadante se reemplazó con tampón HHBS (AAT Bioquest) y las células se expusieron al campo magnético durante 2 h. Luego, el sobrenadante se reemplazó con PBS y los valores de concentración de calcio intracelular se determinaron mediante citometría de flujo FITC (FACS Calibur).
Determinación del potencial de membrana de las células.
El potencial de membrana se determinó utilizando el colorante fluorescente sensible al potencial bis-(ácido 1,3-dibutilbarbitúrico) trimetina oxonol (DiBAC4) (3) (AAT Bioquest). El colorante fluorescente DiBAC4 (3) penetró en las células despolarizadas con alto potencial de membrana, lo que provocó un aumento de la intensidad de la fluorescencia intracelular. DiBAC4 (3) se descargó de las células hiperpolarizadas y la intensidad de la fluorescencia intracelular disminuyó. Las células se cultivaron en placas de 96 pocillos y se expusieron a un campo magnético de 5 mT, 20 Hz durante 2 h los primeros 2 días. Las células se cultivaron en 100 µL de HHBS. El día 3, las células se resuspendieron en 100 µL de 10 µM DIBAC4 (3) AM en solución de trabajo Pluronic F-127 al 0,04% y se incubaron en una atmósfera de CO 2 incubadora a 37 ± 0,18 °C durante 1 h. El sobrenadante se reemplazó con tampón HHBS (AAT Bioquest) y las células se expusieron al campo magnético durante 2 h. Luego, el sobrenadante se reemplazó con PBS y se determinaron los potenciales de membrana celular mediante citometría de flujo FITC (FACS Calibur).
Detección de iones de sodio
Las células se cultivaron en placas de 96 pocillos y se expusieron a un campo magnético de 5 mT y 20 Hz durante 2 h los primeros 2 días. El día 3, el medio se reemplazó con 100 µL de HHBS y 100 µL de SBFI AM 10 µM (Cayman Chemical) en una solución de trabajo de Pluronic F-127 al 0,04%. El sobrenadante se reemplazó con tampón HHBS (AAT Bioquest) después de 4 h de incubación en una cámara de CO2 . incubadora a 37 ± 0,18 °C y las células se expusieron al campo magnético durante 2 h. El ion sodio se determinó a una excitación de 330/80 y una emisión de 528/20 utilizando un comprobador de microplacas.
Detección de iones de potasio
Las células se cultivaron en placas de 96 pocillos y se expusieron a un campo magnético de 5 mT y 20 Hz durante 2 h los primeros 2 días. El día 3, el medio se reemplazó con 100 µL de HHBS y 100 µL de PBFI AM 10 µM (Cayman Chemical) en una solución de trabajo de Pluronic F-127 al 0,04%. Después de 4 h de incubación en CO 2 incubadora a 37 ± 0,18 °C, se reemplazó el sobrenadante con tampón HHBS (AAT Bioquest) y las células se expusieron al campo magnético durante 2 h. La determinación del ion potasio se realizó a una excitación de 330/80 y una emisión de 528/20 utilizando un comprobador de microplacas.
Tintura azul tripán
Se digirieron con tripsina 293 células T, Hepg2 y A549 en la fase de crecimiento logarítmico y se recolectaron. Las células Raji se recolectaron directamente. Después de la centrifugación, las células se tiñeron con el colorante vital azul tripán. Las células vivas se contaron bajo un microscopio óptico invertido (Carl Zeiss, Alemania). Se determinaron las tasas de inhibición del crecimiento celular y se trazaron curvas representativas. Tasa de inhibición (%) = (número de células en el grupo de control − número de células en el grupo del campo magnético) / número de células en el grupo de control × 100%.
Análisis estadístico
Todos los datos se expresaron como media ± error estándar de la media, y se utilizó un análisis de varianza unidireccional para la comparación entre múltiples grupos. a Se utilizó una prueba para comparar los grupos tratados con los no tratados. PAG Un valor < 0,05 indicó una diferencia estadísticamente significativa. Los resultados confirmatorios en Se obtuvo un valor de p < 0,05 al repetir los estudios al menos dos veces. Cada conjunto de experimentos tenía tres muestras paralelas y cada experimento se repitió tres veces.