Os materiais magnéticos eram úteis na terapia do câncer?
Resumo
O câncer é um dos maiores desafios enfrentados pelas pesquisas básicas biomédicas em nosso tempo. O estudo e o desenvolvimento de estratégias terapêuticas eficazes para a terapia do câncer são vitais. Entre os muitos prováveis constituintes principais das nanopartículas , as nanopartículas baseadas em magnetita têm sido amplamente estudadas para a terapia do câncer devido às suas características magnéticas inerentes, design multifuncional, propriedades biodegradáveis e biocompatíveis. As nanopartículas magnéticas também foram projetadas para utilização como agentes intensificadores de contraste para imagens de ressonância magnética, sistemas de administração de medicamentos e, mais recentemente, como um elemento terapêutico na indução de morte celular em terapias de ablação de tumores. Esta revisão teve como objetivo fornecer uma visão geral das várias aplicações das nanopartículas magnéticas e conquistas recentes no desenvolvimento desses materiais avançados para a terapia do câncer.
Palavras-chave
1. Introdução
O advento da ciência e tecnologia em nanoescala tem sido amplamente divulgado como uma mudança de paradigma exaustiva para o diagnóstico e tratamento do câncer. Certamente, o aumento em trabalhos de pesquisa investigando a síntese de sistemas nanoparticulados fez a formação de várias formulações de materiais mostrando efeitos diagnósticos e terapêuticos esperançosos para o tratamento de muitos tipos de câncer em um único nano-fármaco [1] , [2] , [3] . As configurações de nanopartículas consistem em aquelas com núcleos principais de moléculas orgânicas, moléculas inorgânicas ou uma combinação de dois ou mais desses elementos [4] , [5] , [6] . Todas as estruturas básicas têm algumas vantagens e desvantagens que dependem do uso pretendido. Além disso, essas formulações têm propriedades, por exemplo, carga de superfície, hidrofobicidade e tamanho que são ajustáveis, permitindo que sejam melhoradas para uma função favorita [7] , [8] .
As nanopartículas magnéticas (MNPs) são um grupo importante de nanopartículas (NPs) que geralmente são construídas a partir de íons metálicos puros ou de uma mistura de polímeros [9] , [10] . Os exossomos, NPs formados naturalmente, são secretados endogenamente pelas células após a fusão de um compartimento endocítico intermediário e foram identificados como veículos excelentes para a administração de genes e medicamentos. [11] . Vários estudos relataram que exossomos podem ser isolados de meios de cultura de células, particularmente de cultura de células tumorais [12] . No entanto, essas células secretam poucos exossomos e podem oferecer funções estimulantes do câncer e do sistema imunológico devido aos seus ácidos nucleicos e cargas de proteínas das células doadoras [13] , [14] . Recentemente, um cluster de nanopartículas de óxido de ferro superparamagnéticas (SPIONs) baseado em exossomo foi desenvolvido como um veículo de administração de medicamentos direcionado para o tratamento do câncer. Foi revelado que a administração de medicamentos baseada em exossomo aumentou a segmentação do câncer sob um campo magnético externo e reprimiu o tumor [11] .
Os MNPs têm muitas aplicações biomédicas, como liberação controlada de fármacos [15] , biossensores [16] , tratamento do câncer por hipertermia [17] , ressonância magnética (RM) [18] . Outra aplicação de MNPs é a imagem por partículas magnéticas (MPI). MPI é uma nova técnica de imagem com a capacidade de detectar células cancerígenas em diferentes tecidos. Acúmulos de NPs em tecidos cancerígenos em comparação a outros locais podem detectar tecidos cancerígenos. Essa capacidade depende da forma e das características físicas ou químicas dos NPs e de sua geração de sinal. A biodistribuição de partículas magnéticas pode ser avaliada por emissão de fóton único e fluorescência no infravermelho próximo. Partículas de óxido de ferro são materiais eficientes para imagens com alta sensibilidade e os polímeros são compatíveis e degradáveis no corpo [19] . A principal vantagem dos MNPs é sua capacidade de serem manipulados magneticamente com um campo magnético externo. Morfologia, composição química, forma, tamanho e comportamento magnético dos MNPs são os critérios mais significativos na determinação de seus usos biomédicos [10] . Além disso, as propriedades magnéticas e a eficácia dos MNPs in vivo podem ser adaptadas usando um revestimento biocompatível e seguro para aumentar sua adequação para um alvo específico no corpo humano [20] . Este revestimento pode formar várias estruturas para atingir células ou moléculas específicas e é usado para geração de imagens delas. As abordagens de modificação de superfície podem levar à multifuncionalidade dos MNPs [21] , [22] . Como a modificação química oferece funcionalidade multiplexada, por exemplo, administração combinada de medicamentos por hipertermia e imagens multimodais [20] , [23] , [24] .
Foi revelado que a febre pode afetar negativamente o crescimento das células cancerígenas [25] . Além disso, células cancerosas e não cancerosas apresentam comportamento diverso em uma faixa de temperatura de 42 °C a 45 °C. As células não cancerosas podem suportar essas temperaturas por um curto período de tempo, enquanto as células cancerosas realizam apoptose [26] . Assim, manter a temperatura do ambiente celular em hipertermia pode ser uma forma eficaz na terapia do câncer com menos efeitos colaterais [27] . Os MNPs têm um grande potencial para criar calor sob campos magnéticos e aumentar a temperatura do tumor cancerígeno para 42–45 °C [28] . Portanto, a hipertermia é atualmente utilizada no tratamento de muitos tipos de câncer, ou seja, câncer de útero, próstata e mama. [29] , [30] , [31] , [32] .
Outra aplicação dos MNPs é na ressonância magnética para melhorar o direcionamento do tecido [33] . Eles podem ser localizados nos locais do tecido para aumentar o relaxamento do próton e aumentar sua visibilidade [34] . Considerando como um material de próxima geração em ressonância magnética, os MNPs são utilizados para imagens que contêm partículas nanocristalinas que podem ser mais funcionalizadas com materiais de revestimento e ligantes funcionais. Medições mais precisas e eficientes de células e biomarcadores são críticas no diagnóstico rápido e na prevenção de metástase. O diagnóstico precoce do câncer pode evitar consideravelmente o crescimento do câncer e sua metástase para outro tecido [34] . Ferramentas de avaliação do câncer com grande sensibilidade na detecção de algumas frações de direcionamento diferentes que precisam de preparação mínima da amostra para promover um diagnóstico consideravelmente rápido. O uso de MNPs em biossensores tem sido amplamente pesquisado. Esses sistemas propõem vantagens únicas sobre as abordagens de detecção convencionais [3] , [35] .
Esta revisão é dedicada a discutir avanços recentes no emprego de materiais baseados em magnetismo, incluindo materiais de óxido de ferro superparamagnéticos , materiais magnéticos baseados em sílica, materiais magnéticos de ouro, materiais magnéticos baseados em quitosana, materiais magnéticos baseados em metal, materiais magnéticos baseados em carbono, materiais magnéticos modificados com polietilenoglicol (PEG), polímeros biocompatíveis e outros materiais magnéticos para monitoramento e diagnóstico de câncer por meio de modalidades de imagem, terapia do câncer por meio do transporte de agentes bioterapêuticos e quimioterápicos, terapias fototérmicas e hipertermia magnética.
2. Aplicações de materiais magnéticos avançados para terapia do câncer
O uso de materiais baseados em magnetismo em aplicações biomédicas tem grande potencial no campo da terapia do câncer. Especialmente, há inúmeras propriedades de nanomateriais baseados em magnetismo, incluindo grande área de superfície e propriedades ópticas únicas que permitem o desenvolvimento de novos ensaios de tratamento do câncer [36] . Revisaremos essas características dependentes de material dos NPs em relação à sua eficácia na terapia do câncer por meio de hipertermia, administração de medicamentos, etc.
2.1. Materiais baseados em nanopartículas de óxido de ferro superparamagnéticas para terapia do câncer
NPs de óxido de ferro superparamagnéticos (SPIONs) são plataformas transportadoras de medicamentos auspiciosas devido à sua alta biocompatibilidade , T 1 e efeitos de contraste T2 para ressonância magnética, funcionalidades de superfície flexível e suspensões coloidais estáveis in vivo [37] , [38] , [39] . Além disso, os SPIONs podem ser metabolizados e biodegradados sem se acumularem no corpo [34] . A Food and Drug Administration (FDA) dos EUA forneceu vários tipos de SPIONs para utilização clínica [40] . Exemplos recentes de materiais baseados em SPIONs para terapia do câncer são revisados abaixo.
Zuvin e outros. [41] demonstraram os efeitos anticâncer de SPIONs revestidos com ácido poliacrílico em células tumorais de mama na baixa intensidade de campo magnético de 0,8 kAm -1 pela ligação do anticorpo anti-HER2 aos NPs. Os NPs modificados foram internalizados com sucesso pelas linhas celulares MDA-MB-453 e SKBR3 HER2-positivas. As células cancerosas com superexpressão de HER2 foram alvos e então mortas por um anticorpo anti-HER2 conjugado a SPIONs por hipertermia feita por indução sob magnitudes e intensidades de campo magnético mais baixas. Os NPs modificados também mostraram baixa toxicidade para as linhas celulares, resultando em uma redução perceptível na sobrevivência em células MDA-MB-453 e proliferação celular, expondo-as à hipertermia [41] . Comparado com outros métodos terapêuticos, este método aumentou a especificidade, consequentemente, também pode fornecer um tratamento mais eficaz. Além disso, diversas características, como alta estabilidade, tamanho ultrapequeno e resistência à agregação, o tornam mais apropriado para estudos in vivo posteriores.
NPs guiados magneticamente são candidatos promissores em sistemas de administração de medicamentos direcionados. Para transportar MNPs nus ou carregados com medicamentos para uma área-alvo, é necessário um campo magnético externo constante [42] . SPIONs são uma das melhores opções que têm adquirido cada vez mais atenção por suas aplicações na terapia do câncer devido à sua excelente estabilidade, boa biodegradabilidade, baixa toxicidade e superparamagnetismo [43] . [44] . O sistema de administração de medicamentos guiado magneticamente é simplificado principalmente com o desenvolvimento de NPs multifuncionais por encapsulamento de SPIONs e agentes quimioterápicos dentro dos sistemas poliméricos desejados. Esses NPs multifuncionais podem administrar os agentes de maneira direcionada dentro dos tumores. Até o momento, os estudos relatados sobre os MNPs multifuncionais não investigaram completamente suas propriedades físico-químicas, incluindo citotoxicidade, solubilidade, propriedades magnéticas , etc. Um novo NPs magnético-polimérico multifuncional (MF-MPNs) foi explicado por Kandasamy et al. [45] com base em ferrofluidos por encapsulamento individual de SPIONs hidrofóbicos revestidos de oleilamina nos NPs de poli(ácido láctico- co -glicólico) (PLGA), bem como dois medicamentos, curcumina (Cur) ou verapamil (Ver). Eles investigaram as propriedades magnéticas, dispersibilidade, biocompatibilidade e eficácias de aquecimento dos MF-MPNs selecionados. Por fim, a eficiência terapêutica dos MF-MPNs foi validada no tratamento do câncer de fígado HepG2 por meio de dois mecanismos diferentes, termoterapia por meio do uso de SPIONs e quimioterapia por meio de Cur ou Ver. Todos os resultados revelaram que os NPs de dupla droga e SPIONs-PLGA melhoraram a eficiência terapêutica em células tumorais HepG2 por meio do tratamento integrado (quimioterapia e termoterapia) em comparação ao tratamento individual. Portanto, os ferrofluidos baseados em MF-MPNs (NPs de PLGA co-carregados com SPIONs/dupla droga) mostraram possíveis opções terapêuticas para terapia multimodal in vitro do câncer. Também foi demonstrado que o encapsulamento de PLGA pode melhorar a estabilidade dos SPIONs sem alterar ou afetar a potência fototérmica, o que pode minimizar a toxicidade e maximizar a eficiência do tratamento da formulação [46] , [47] .
A terapia do câncer por hipertermia magnética é outra opção de tratamento convencional, como quimioterapia e radioterapia [48] . Curiosamente, ele tem capacidade de direcionamento e baixa toxicidade sistêmica. No entanto, essa abordagem tem grandes problemas na tradução clínica, como suscetibilidade de aglomeração dos agentes de aquecimento nano em meios aquosos, geração e dissipação descontroladas de calor na região alvo e depuração evitada por sistemas reticuloendoteliais. A esse respeito, o SPION como um potencial agente de aquecimento nano direcionado estabilizado por uma conformação micelar foi fabricado para novas aplicações terapêuticas. Ele foi coberto com uma fina camada de policaprolactona (PCL) para obter maior termosensibilidade e citocompatibilidade. Com base nas descobertas in vitro, a viabilidade das células tumorais do fígado humano na maior concentração de SPIONs (100 μg/mL) foi consideravelmente diminuída para 40,1 ± 0,9% na faixa de temperatura de hipertermia segura. Esta faixa foi obtida com os efeitos de aquecimento de SPIONs revestidos de polímero na existência de campo magnético alternado (AMF), representando-os na ocorrência de citotoxicidade ligada ou desligada de SPIONs revestidos de polímero enquanto os expõe ao AMF [49] . As vantagens do SPION revestido de PCL incluem estabilidade estrutural, melhor dispersão, citocompatibilidade e aquecimento controlado sob condições de hipertermia que o apresentam como uma estratégia promissora para o direcionamento ativo das células do carcinoma no futuro [49] .
O processo de síntese de NPs de óxido de ferro (IONs) foi avaliado em vários estudos utilizando precursores de ferro (II). No entanto, os procedimentos de síntese incluem o uso de diferentes reagentes alcalinos ou soluções de bicarbonato , que não são desejáveis para fins biomédicos [50] , [51] . Os impactos de diferentes circunstâncias oxidativas foram avaliados nas características magnéticas e físico-químicas e na citocompatibilidade de SPIONs sintetizados utilizando um único reagente alcalino e precursor de ferro (II). Pela primeira vez, eles avaliaram a síntese de SPIONs por meio de um único precursor. As condições de síntese foram otimizadas onde o N 2 :O 2 taxa de fluxo desempenhando um papel crítico no direcionamento de usos práticos para terapia do câncer. Várias características de dose-resposta dos SPIONs sintetizados em várias intensidades de campos magnéticos alternados (AMF) também foram investigadas. Então, a eficácia do aquecimento por indução dos SPIONs ideais foi avaliada sob diferentes exposições a AMF. A viabilidade celular foi reduzida para 49 ± 0,3% pela atividade citotóxica dos SPIONs sintetizados nas células de câncer de fígado humano sob condições de hipertermia. As descobertas revelaram que tais agentes de nanoaquecimento magnético são candidatos eficazes para objetivos de terapia do câncer.
NPs conjugados com anticorpos podem manter a estrutura química dos medicamentos e administrá-los de forma controlada com baixa toxicidade. Como algumas indicações de câncer de mama têm opções terapêuticas restritas, esse campo oferece esperança para o tratamento futuro de pacientes com câncer de mama. No entanto, a reticulação de anticorpos não é seletiva e causa a principal desvantagem de falta de controle na orientação do anticorpo na superfície dos NPs [52] . Em um estudo publicado recentemente, a capacidade teranóstica dos SPIONs foi avaliada para diagnosticar e tratar o câncer estabelecendo uma única nanosonda integrada. SPIONs revestidos com oleilamina (SPION-Ol) foram sintetizados e modificados com trastuzumabe (TZ) e protoporfirina (PP). A ablação fototérmica e os valores de relaxividade r2 foram determinados juntamente com irradiação a laser in vitro e ressonância magnética. Não houve citotoxicidade após a incubação de células MCF-7 sob diferentes concentrações de agentes teranósticos e SPION-Ol. Os resultados mostraram que o SPION-PP-TZ solúvel em água é um agente bimodal auspicioso para o diagnóstico e tratamento de células de câncer de mama positivas para o receptor do fator de crescimento epidérmico humano (EGFR) 2, utilizando terapia fototérmica e um agente de contraste de ressonância magnética T 2 [53] .
Uma formulação de SPIONs com biopolímeros de poliaspartamida (PA) foi desenvolvida para o tratamento de células tumorais através do método de hipertermia. PA é um polímero biodegradável e biocompatível com uma estrutura de polissuccinimida que tem um papel crítico no encapsulamento de SPIONs. Carreadores de fármacos multifuncionais podem ser conjugados com outros grupos como biotina para aumentar a capacidade de captação de SPIONs para receptores de células tumorais. As descobertas revelaram que um ótimo desempenho biocompatível é obtido pelo encapsulamento de nano aquecedores de SPIONs com biopolímero de PA em termos de viabilidade celular e representou atividades úteis de eliminação de câncer em testes de hipertermia in vivo e in vitro. SPIONs encapsulados em PA exibiram boa capacidade de aquecimento via experimento de hipertermia em condições ambientais, maior capacidade de captação celular de câncer e alta citotoxicidade contra células cancerígenas . Esses resultados abrirão novas possibilidades para o tratamento do câncer no futuro [54] .
Estudos anteriores mostraram que uma fração bioativa específica deve ser instalada em SPIONs para tratar metástase óssea de câncer de mama e direcionar tecidos ósseos. Foi revelado que peptídeos ácidos de tamanho curto compreendendo sequências repetitivas de ácido aspártico [55] se ligam preferencialmente à hidroxiapatita , como o principal elemento na composição orgânica do osso. Pang et al. [56] relataram exemplos de material baseado em SPIONs para tratamento de câncer. Eles utilizaram SPIONs de direcionamento ósseo para inibir furina para aliviar metástase óssea de câncer de mama. Tanto na função osteoclástica quanto na invasão de células tumorais, a proproteína convertase furina desempenha um papel vital. O inibidor de furina, um peptídeo compreendendo uma sequência repetitiva de lisina-ácido aspártico-ácido glutâmico, foi administrado por meio de SPIONs de direcionamento ósseo para aumentar a circulação de NPs na corrente sanguínea [56] . Além disso, um ligante responsivo às metalopeptidases de matriz (MMPs) 2/9 foi adicionalmente anexado ao peptídeo inibidor da furina para aumentar a especificidade dos NPs [57] , [58] . O MMP2/9 é um estímulo responsivo a enzimas ativado com fenótipos metastáticos/invasivos, que é um elemento crucial da progressão do tumor. Simultaneamente, as MMPs, particularmente a MMP9 , também são enzimas críticas no processo de reabsorção óssea. Portanto, um sistema SPIONs multirresponsivo e multifuncional foi estabelecido. Ele tem como alvo específico os locais metastáticos ósseos, libera o peptídeo inibidor da furina por meio da clivagem induzida por MMP2/9 e gera contraste para a imagem de ressonância magnética, levando aos impactos anti-osteoclásticos e anticâncer teranósticos (Fig. 1). Os dados in vivo e in vitro revelaram que tal sistema pode prevenir a invasão do câncer de mama e a reabsorção óssea osteoclástica, resultando em osteólise aliviada [56] .
Os NPs conjugados a peptídeos mostraram maior seletividade, maior afinidade de ligação e mais eficácia terapêutica. Mas, os comportamentos dos NPs conjugados a peptídeos em condições fisiológicas, por exemplo, espaço intracelular e corrente sanguínea, não foram compreendidos. Além disso, a vulnerabilidade dos peptídeos à degradação enzimática [59] , e a possível imunogenicidade dos NPs conjugados com peptídeos projetados, e a perda da função biológica dos peptídeos que se combinam covalentemente com os NPs são algumas desvantagens comuns para uso in vivo e clínico [60] , [61] . A partir desta seção, conclui-se que diferentes tipos de materiais baseados em SPIONs foram aplicados para terapia do câncer. Uma visão geral dos estudos relatados que utilizaram materiais baseados em SPIONs para terapia do câncer revelou que a combinação da abordagem SPION direcionada à hipertermia com anticorpo anti-HER2 marcado com corante foi a abordagem eficiente que efetivamente atinge o método terapêutico local, específico do tumor e muito eficaz contra o câncer de mama. Além disso, a instalação de uma fração bioativa especial em SPIONs pode ser usada eficientemente para direcionar a metástase óssea do câncer de mama devido à dificuldade de administrar medicamentos anticâncer ao osso. No entanto, a seletividade inadequada do tecido, a baixa capacidade de carga de medicamentos e a biodistribuição descontrolada de SPIONs são as principais desvantagens que limitam sua tradução clínica.
2.2. Materiais magnéticos à base de sílica para terapia do câncer
Materiais à base de sílica são materiais biocompatíveis com alta estabilidade química e física [62] , [63] . Recentemente, vários estudos foram realizados para produzir materiais de sílica mesoporosos ocos para aumentar a eficiência do carregamento de fármacos [64] . Para a produção de esferas de sílica ocas com estruturas mesoporosas, os moldes duros e macios internos foram eliminados para criar a estrutura oca do nanocompósito [65] . No entanto, as abordagens de síntese atuais têm limitações como procedimentos demorados e configuração experimental complicada devido à complexidade do modelo de remoção [62] , [63] , [66] . Portanto, é significativo desenvolver uma técnica fácil para nanocompósitos ocos à base de sílica mesoporosa [67] . Aqui, são fornecidos exemplos recentes de materiais magnéticos à base de sílica para terapia do câncer.
Uma nova plataforma teranóstica foi construída por Hsiao et al. [68] , compreendendo um fármaco e um carreador que ácido fólico-Európio-gadolínio-sílica mesoporosa foi enxertado via ligação dissulfeto com L-cisteína (FA-EuGd-MSNs-SS-Cys). Pode fornecer um instrumento terapêutico e diagnóstico tudo-em-um com várias funcionalidades significativas, como rastreamento, imagem e administração terapêutica de fármacos. Para criar o carreador (EuGd-MSNs), Európio (Eu 3+ ) e Gadolínio (Gd 3+ ) foram dopados em MSNs e a conjugação da Cys na superfície de EuGd-MSNs é realizada por ligação dissulfeto [69] . Portanto, a penetração simples é permitida na célula enquanto a liberação controlada da terapia medicamentosa . Além disso, o direcionamento de FA foi obtido de forma mais eficiente com especificidade e seletividade de fagocitose. As descobertas revelaram que FA-EuGd-MSNs-SS-Cys teranósticos multifuncionais podem ser nanoplataformas eficazes para tratamento de câncer guiado por imagem e agentes terapêuticos simultâneos. A avaliação da captação celular indicou que mais células cancerígenas são capturadas por FA-EuGd-MSNs em comparação com EuGd-MSNs. Os materiais celulares revelaram que o Eu 3+ emitiu a fluorescência vermelha intensa, uma quantidade considerável de FA-EuGd-MSNs é engolida com as células Hela. Além disso, a sensibilidade à fotoluminescência é aumentada pela funcionalidade paramagnética do Gd 3+ por meio de ressonância magnética. O Cys apareceu como um reagente anticâncer em uma avaliação de citotoxicidade de FA-EuGd-MSNs-SS-Cys usando ensaio de brometo de 2,5-difenil-2H-tetrazólio (MTT). Excelentes características também foram reveladas por EuGd-MSNs, como a inexistência de citotoxicidade, estabilidade e biocompatibilidade decente ao cultivar com células L929 normais [68] . Vantajosamente, esta abordagem pode operar como uma plataforma nano útil para um agente terapêutico simultâneo e tratamento guiado por imagem para câncer. O diagnóstico e o tratamento simultâneos nesta pesquisa são um benefício importante em relação a estudos anteriores.
A terapia de hipertermia baseada em MNPs tem uma variedade de benefícios em comparação à terapia de hipertermia convencional, incluindo administração direcionada, resultando em tratamento mais seletivo e eficaz, hipertermia localizada, travessia eficiente da barreira hematoencefálica (BHE), redução da dose efetiva necessária de medicamentos quimioterápicos tóxicos, etc. [70] , [71] , [72] . A este respeito, um magnético com potenciais propriedades terapêuticas de quimio-hipertermia foi estabelecido em termos de NPs de sílica mesoporosa magnética revestida com copolímero termo-responsivo (MMSNs) com poli(N-isopropil acrilamida- co -ácido metacrílico) (P(NIPAM- co -MAA)). O carregamento do modelo de fármaco anticâncer, cloridrato de doxorrubicina (DOX.HCl), foi realizado em MMSNs@P(NIPAM- co -MAA). O desempenho de liberação do fármaco responsivo à temperatura e ao pH foi exibido por DOX-MMSNs@P(NIPAM- co -MAA) e MMSNs@P(NIPAM- co -MAA). A liberação de DOX foi acelerada por um ambiente de pH mais baixo e temperatura de hipertermia. Os resultados da cultura de células revelaram hipertermia, levando a uma maior eficácia para matar células cancerígenas. Portanto, MMSNs@P(NIPAM- co -MAA) apresentam uma plataforma auspiciosa para o tratamento do câncer.
Em outro estudo, um MnSiO 3 biodegradável responsivo ao microambiente tumoral @Fe 3 O 4 nanoplataformas foram fornecidas para tratamento combinatório de câncer orientado por MRI de modo duplo. Medicamentos anticâncer foram carregados eficientemente nas nanoplataformas nas quais Fe 3 O 4 NPs bloqueiam os poros de NPs de MnSiO 3 , reduzindo o vazamento de fármacos em circunstâncias fisiológicas normais. Em alta concentração de glutationa (GSH) ou condições fracamente ácidas, as nanoplataformas foram quebradas, levando ao Fe 3 O 4 Separação de NPs e liberação rápida do Mn 2+ íons e fármacos. Além disso, a área de superfície específica das partículas magnéticas pode ser aumentada pelo Fe 3 O 4 esfoliado nanocristais enquanto melhora a atividade catalítica da reação do tipo Fenton nas células cancerígenas. Portanto, mais OH é gerado, aumentando a apoptose das células HeLa. Com base nos testes in vitro e in vivo, foi obtida uma melhora notável no contraste de ressonância magnética de modo duplo e na atividade anticâncer da nanoplataforma produzida, juntamente com a diminuição da toxicidade sistêmica. Além disso, o manganês paramagnético (Mn 2+ ) pode desempenhar um papel na redução de distúrbios e T 1 e tempos de relaxamento T 2 ao mesmo tempo. Tal nanoplataforma multifuncional poderia diminuir eficientemente os efeitos adversos do medicamento e poderia ser útil para o monitoramento em tempo real da liberação do medicamento. Portanto, esta pode ser uma opção auspiciosa para terapia sinérgica do câncer e ressonância magnética responsiva ao pH em usos clínicos [73] .
Para o tratamento eficaz de defeitos ósseos baseados em tumores, ainda é um grande desafio projetar e construir biomateriais multifuncionais. Tanto a quitosana (CS) quanto o biovidro (BGs) foram amplamente encontrados para uso em reparo ósseo devido à sua brilhante osteocondutividade, biodegradabilidade adequada e boa biocompatibilidade. SrFe 12 O 19 (ferritas hexagonais de estrôncio) como um MNPs foi modificado com andaime poroso CS/BG mesoporoso e ilustrou a função antitumoral e a regeneração óssea. Foi descoberto que a diferenciação osteogênica de células-tronco e a regeneração de osso novo foram consideravelmente promovidas por NPs magnéticos de SrFe 12 O 19 em andaime poroso de biovidro (BG)/CS mesoporoso modificado (MBCS) através da via BMP-2/Smad/Runx2 ativada. Além disso, apresentou agentes fototérmicos perfeitos para matar células cancerígenas residuais via tratamento fototérmico NIR. Ao irradiar laser infravermelho próximo (NIR), a apoptose e a ablação do tumor foram desencadeadas pelas temperaturas elevadas dos tumores cocultivados com MBCS. Comparado ao grupo de andaime puro, a excelente eficácia antitumoral foi demonstrada pelo grupo MBCS/NIR contra a ablação por hipertermia do osteossarcoma . Vantajosamente, os MBCS multifuncionais com funções superiores de terapia fototérmica e regeneração óssea podem ser usados efetivamente para tratar defeitos ósseos baseados em tumores [74] .
Com o progresso atual na síntese de nanocarreadores , é permitido usar sistemas de administração de fármacos duplos para encapsular dois fármacos e melhorar os impactos do tratamento. A este respeito, os NPs de ácido tânico Fe 3 O 4 @SiO 2 foram usados como um sistema de administração de fármacos responsivo ao pH para administração simultânea de fármacos anticâncer de metotrexato (MTX) e DOX. Foram realizados estudos sobre desempenhos de liberação e carregamento de fármacos in vitro. Os nanocarreadores MTX e DOX carregados exibiram liberação controlada por pH de fármacos em um modo sustentado. De acordo com o estudo de citotoxicidade do nanocarreador em branco versus linhagens celulares MCF-7 possui um futuro citocompatível. No entanto, a coadministração de DOX com MTX possuía citotoxicidade considerável para as linhagens celulares MCF-7 como resultado da formação de esqueletos de pseudopeptídeos no nanocarreador. O vazamento mínimo de fármaco foi demonstrado pelo desempenho de liberação de fármaco in vitro em pH 7,4 do Fe 3 O 4 @SiO 2 @Tann. Isso reduz os impactos adversos nos tecidos normais. Portanto, a liberação do medicamento é consideravelmente maior em pH 5, aumentando a citotoxicidade para tecidos tumorais. Além disso, o teste MTT revelou que o nanocarreador carregado com MTX-DOX possuía maior citotoxicidade contra células MCF-7 em comparação aos medicamentos livres. As descobertas revelaram que o Fe 3 O 4 @SiO 2 @Tann poderia ser usado como um potencial sistema de administração de medicamentos direcionados aos tecidos cancerígenos. Além disso, o potencial para tratamento anticâncer foi encontrado pelos MNPs de núcleo-casca duplos responsivos ao pH carregados com medicamentos anticâncer duplos preparados [75] . As vantagens dessa abordagem incluem biocompatibilidade, estabilidade térmica , rica variedade e fácil controle da morfologia, estrutura e tamanho. Além disso, o uso simultâneo de dois medicamentos pode aumentar muito seu efeito terapêutico.
Atualmente, um grande interesse tem sido atraído pelo método de fotoluminescência-RM bimodal como resultado de seu maior potencial em práticas clínicas e pesquisas biomédicas. Uma nova nano-sonda bimodal alvo de tumor, FA-Gd-Tb@SiO 2 foi feito por Song et al. através da ligação covalente de um complexo Tb 3+ luminescente , N, N, N, N-(4-fenil-2,2:6,2-terpiridina-6,6-diil) bis(metilenonitrilo) tetraacetato-Tb) na estrutura de NPs de sílica , juntamente com sua ligação de superfície de uma molécula alvo de tumor (ácido fólico, FA) e um agente de contraste de RM gadoteridol (Gd-DO 3 A) ( Fig. 1 ). A nanosonda criada exibe alto r 1 e r 2 relaxividades, ligação direcionada ao tumor e luminescência mais forte e de longa duração. Com base na imagem de luminescência temporizada celular (TGL) in vitro, a nanosonda FA-Gd-Tb@SiO 2 pode ser identificada e acumulada em células tumorais que superexpressam o receptor FA . Além disso, a avaliação in vivo indicou que a nanosonda preparada pode melhorar eficientemente a intensidade de TGL e o contraste de RM ponderado em T 1 no tecido canceroso. Portanto, contribui para o rastreamento e detecção precisos de células tumorais e para a identificação e tratamento clínico de tumores. Vantajosamente, este estudo sugere um novo método para o design de um nanofármaco muito direcionado, multifuncional e de tamanho controlado, com um efeito fototérmico excepcional e excelente desempenho responsivo ao pH na liberação e carregamento do fármaco. [76] .

Figura 1 . O processo de síntese da nanosonda de imagem TGL/MR bimodal e seu uso para rastrear células tumorais no mic portador do tumor. (Reproduzido da publicação Ref. [76] , Copyright (2021), com permissão da Elsevier (código de licença; 5157770388261).
Uma pesquisa interessante foi relatada para uma combinação de tratamento fototérmico e quimioterápico com Fe 3 O 4 @SiO 2 carregado com DOX sistema de nano-fármaco. Utilizando uma técnica solvotérmica simples, foi preparado por Fe 3 O 4 MNPs para controlar a proporção dos reagentes para obtenção de Fe 3 O 4 magnético partículas com um tamanho modificável (20∼400 nm). O carregamento de DOX nas partículas compostas de Fe 3 O 4 @SiO 2 pH -sensível e liberação simples ocorreu em um ambiente ácido. Isso é vital para a liberação específica do fármaco de células tumorais, uma vez que as células tumorais possuíam ambientes internos ácidos, reduzindo os impactos colaterais tóxicos nas células normais. Por irradiação de luz NIR (808 nm), a terapia fototérmica foi induzida pelo efeito fototérmico criado por Fe 3 O 4 @SiO 2 @DOX enquanto aumentava a liberação do fármaco. A captação celular e a citotoxicidade dos nano-fármacos Fe 3 O 4 @SiO 2 @DOX foram avaliadas em células tumorais de pulmão A549. Quase 82,8% das células de câncer de pulmão A549 puderam ser mortas pelo tratamento com Fe 3 O 4 @SiO 2 @DOX contendo apenas 10 μg/mL de DOX. Além disso, 81,3% das células do carcinoma pulmonar A549 foram mortas durante a incubação com Fe 3 O 4 @SiO 2 @DOX que compreende apenas 0,5 μg/mL de DOX e 15 min de irradiação NIR, propondo assim um efeito quimio/fototérmico sinérgico excepcional no tratamento do câncer [77] .
Recentemente, uma técnica fácil para construir esferas de sílica mesoporosa oca de IONP (IONP-HMSs) foi projetada e estabelecida por meio da abordagem de microemulsão de óleo em água. Este sistema de administração de fármacos tem muitas vantagens, incluindo geração simples em larga escala, tamanho de poro uniforme ajustável, alta área de superfície e grandes volumes de poros . Neste estudo, esferas de IONP encapsuladas em brometo de cetiltrimetilamônio (CTAB) foram fornecidas como modelo para construir cascas de sílica mesoporosa. Na liberação e carregamento de DOX in vitro, os IONP-HMSs foram utilizados como nanocarreadores. Além disso, foi realizada uma análise sobre a eficácia de IONP-HMSs carregados com DOX para tratamento de câncer e sua biocompatibilidade por meio de exames de citotoxicidade celular. As descobertas revelaram que os IONP-HMSs possuíam uma alta eficiência de carregamento de fármacos que permite a liberação de DOX desencadeada por pH in vitro. Além disso, os IONP-HMSs representaram excelente biocompatibilidade e aumentaram o efeito terapêutico do DOX nas células HeLa [67] .
2.3. Materiais magnéticos de ouro para terapia do câncer
NPs plasmônicos como o ouro são utilizados para medicamentos de liberação controlada como resultado de sua alta conversão de energia fotoquímica em calor [78] . Isso pode ativar a liberação do fármaco pré-carregado [79] . Para a terapêutica do cancro, os nanocompósitos multifuncionais com interações de interface e estruturas controladas são veículos atrativos [80] . Nanocompósitos ativados magnética e opticamente, como NPs do tipo haltere, compreendendo duas superfícies químicas que são apropriadas para administração de medicamentos sensíveis ao pH e direcionamento sincronizado de células [81] , [82] . No entanto, um sistema responsivo ao pH pode não agir bem em mudanças ambientais complexas ao interferir com outros fatores no procedimento de liberação. A seguir, revisaremos os estudos publicados recentemente sobre materiais de ouro magnético para terapia do câncer.
Atualmente, Jian et al. sintetizaram MNPs de ouro tipo haltere carregados positivamente (Au-Fe 3 O 4 NPs) para entrega de aptâmeros de VEGF direcionados em células tumorais ovarianas . A interação de dominância entre aptâmeros de DNA e direcionamento de VEGF com a superfície de Au-Fe 3 O 4 é absorção eletrostática. A microscopia confocal foi usada para observar o reconhecimento direcionado de células tumorais ovarianas por meio de Au-Fe 3 O 4 funcionalizados por aptâmeros. NPs (Apt-Au-Fe 3 O 4 NPs). Foi descoberto que Apt-Au-Fe 3 O 4 NPs se ligam especificamente com células tumorais ovarianas SKOV-3, resultando na liberação intracelular marcante de aptâmeros sobre radiação de luz ressonante de plasmon. Portanto, a inibição in vitro é aumentada versus a proliferação de células tumorais. As descobertas revelaram o alto potencial de Apt-Au-Fe 3 O 4 NPs como um transportador de hipertermia de câncer direcionado por meio de controle remoto com alta resolução temporal/espacial. As características e aptidões únicas dos aptâmeros incluem grande afinidade de ligação, tamanho pequeno, alta especificidade, não imunogenicidade e facilidade de modificação em comparação com os anticorpos monoclonais tradicionais. As principais desvantagens dos aptâmeros para usos clínicos contêm baixa seletividade que os restringe no direcionamento celular e na liberação exata de aptâmeros. Para aplicações terapêuticas eficientes e diagnósticos altamente sensíveis, o Au-Fe 3 O 4 tipo haltere Os NPs terão grande potencial como nano-portadores [84] .
A eficiência da terapia fototérmica no tratamento do câncer foi demonstrada em estudos anteriores. No entanto, não é provável assegurar a eliminação seletiva e completa de todas as células cancerígenas, porque inúmeras células podem escapar e causar a recorrência do câncer [85] . Portanto, a combinação de duas ou mais abordagens terapêuticas pode superar as severas restrições encontradas pela utilização separada de cada tratamento. [86] , [87] , [88] . A terapia quimio/fototérmica direcionada ao adjuvante é uma das modalidades oncológicas integradas. Isso pode ser aplicado para administração de medicamentos e aumento da temperatura local no local do tumor, sem influenciar os tecidos adjacentes normais. [89] , [90] , [91] , [92] . Este tratamento integrado pode ser obtido utilizando um nanohíbrido tudo-em-um. Ele pode ser acionado usando feixes de laser servindo como estímulo externo para induzir fototermicamente e atuar como nanocarreadores de drogas [93] . Além disso, os efeitos térmicos podem aumentar as respostas celulares para drogas quimioterápicas. Portanto, esta terapia pode ser administrada em doses mais baixas [94] , [95] . Recentemente, esforços adicionais foram atribuídos ao desenvolvimento de NPs teranósticos potentes e à integração de agentes diagnósticos e terapêuticos para terapia eficaz do câncer. Elbialy et al. estabeleceram NPs de ouro magnético multifuncionais (MGNPs) para administração seletiva do fármaco no local do tumor em um modo de liberação controlada utilizando direcionamento magnético; estimulam a terapia fototérmica com geração de calor por absorção de laser próximo ao NIR e servem como agentes de contraste para ressonância magnética. Os MGNPs produzidos foram caracterizados por meio de vários métodos físicos. Em seguida, foram conjugados com PEG e DOX para formar conjugados MGNP-DOX. A maior eficiência do MGNP-DOX para tratamento quimio/fototérmico integrado foi encontrada tanto in vivo quanto in vitro. Os estudos imuno-histoquímicos e o exame histopatológico confirmaram a eficiência do MGNP-DOX como material teranóstico. Além disso, o MGNP-DOX representou um potencial decente como agentes de contraste para ressonância magnética para terapias sinérgicas quimio/fototérmicas direcionadas. Este trabalho aumenta a compreensão desta política terapêutica, otimizando e usando MGNPs como sistemas multifuncionais de administração de medicamentos [96] . Além disso, em outro estudo, um sistema multifuncional de administração de medicamentos foi desenvolvido com base em hemácias (RBCs) para administração de medicamentos e terapia combinada guiada por imagem de câncer. MNPs revestidos com cloro e6 (Ce6), foram anexados à membrana de RBCs e então DOX foi carregado dentro dos RBCs. Dados de imagem ex vivo e in vivo mostraram o direcionamento tumoral induzido por campo magnético muito eficiente desses RBCs após injeção intravenosa em camundongos [97] .
O câncer de mama triplo-negativo (TNBC) é um tipo de câncer muito agressivo, que é difícil de curar por meio de quimioterapia comum. A razão é principalmente a resistência aos medicamentos TNBC e a falta de capacidade eficiente de direcionamento de tumores dos medicamentos atuais [98] . Portanto, é urgentemente necessário desenvolver novas abordagens para terapia de TNBCs de alta eficiência e precisão.
Uma nano-heteroestrutura magnética multifuncional de ouro foi fabricada com fotossensibilizador Ce 6 carregamento (MF-MGN@Ce 6 ) para tratamento fotodinâmico e fototérmico sinérgico (PTT/PDT) de TNBC ( Fig. 2 ). O peptídeo molecular de direcionamento de mitocôndrias e de direcionamento de membrana celular de cRGD de TPP foi funcionalizado sobre o nanosistema para obter MF-MGN@Ce 6 @RT. As avaliações in vitro e in vivo revelaram excelente biocompatibilidade de MF-MGN@Ce 6 @RT. As descobertas revelaram que o design de direcionamento duplo cRGD/TPP garante a entrega precisa de MF-MGN@Ce 6 @RT para tumores TNBC. Ele também melhorou consideravelmente os efeitos fototerapêuticos do nanosistema. A heteroestrutura de MF-MGN@Ce 6 @RT integrando ambos os componentes de ouro e óxido de ferro , MF-MGN@Ce 6 @RT foi revelada como um fator de contraste superior para imagens trimodais de MRI/CT/PA de tumores in vivo. Portanto, leva à supressão completa do crescimento do tumor. Seus resultados apresentam novas nanoplataformas para identificação e tratamento altamente eficientes e precisos de TNBCs. [99] .

Figura 2 . Diagramas esquemáticos para fabricação de MF-MGNs@Ce 6 @RT e sua aplicação em diagnóstico multimodal, fototerapia combinada com tratamento fototérmico e fotodinâmico. (Reproduzido da publicação ref. [99] , Copyright (2021), com permissão da Elsevier (código de licença; 5157770618319).
2.4. Baseado em quitosana magnética para terapia do câncer
Recentemente, a aplicação de polissacarídeos atraiu muita atenção na nanomedicina [100] , [101] . Particularmente, a quitosana (CS) como um polissacarídeo natural tem sido utilizada em alguns usos médicos [102] , de modo que as terapias contra o câncer por CS como veículo de administração do fármaco foram amplamente descritas como um método promissor e benéfico com grande flexibilidade, biocompatibilidade e eficácia. [103] , [104] . Com o avanço dos estudos baseados em polissacarídeos, grandes avanços foram alcançados no campo da administração direcionada de medicamentos em ensaios clínicos , bem como em pesquisas [105] , [106] . Aqui, discutiremos o recente avanço do material magnético baseado em CS para terapia do câncer.
Shanavas et al. avaliaram MNPs híbridos com 'núcleo' de PLGA e superfície modificada com 'casca' de conjugado de folato-CS como contraste de RM e agentes terapêuticos anticâncer simultâneos. Os conjugados de folato-CS foram preparados utilizando química de reticulação de carbodiimida para cobrir SPIONs bem compactados com uma camada adicional de docetaxel carregado com PLGA. Para melhor encapsular os cristais dentro da matriz polimérica , uma proporção ótima de SPION para PLGA foi fixada em 1:10 para fornecer um recurso de magnetização considerável ao nanocompósito para uso como um agente de contraste de RM. A liberação de medicamentos contra o câncer do polímero CS é realizada por estímulos externos e internos ( Fig. 3 ). Neste estudo, em pH ácido, o revestimento de CS sensível ao pH desencadeou a liberação de medicamentos de NPs. A administração de SPION e docetaxel direcionada ao receptor foi fornecida por NPs híbridos biocompatíveis para tratamento anticâncer e ressonância magnética, respectivamente, conforme examinado em células cancerígenas negativas e positivas para o receptor de folato. Melhor captação celular foi demonstrada pelo direcionamento do receptor de ácido fólico , portanto, a citotoxicidade foi aumentada contra células KB com superexpressão do receptor de folato. A captação celular aumentada aumentou diretamente a eficácia anticâncer e diminuiu o T 2 tempo de relaxamento do ambiente da célula tumoral. Portanto, imagens de contraste de ressonância magnética ponderadas em T 2 mais escuras foram fornecidas em comparação com as células de controle. O imenso potencial deste agente teranóstico híbrido núcleo/casca biocompatível direcionado ao receptor foi encontrado para imagens de RM simultâneas e tratamento de câncer [107] .

Figura 3 . Liberação de medicamentos anticâncer de nanocarreadores de quitosana em resposta a estímulos internos/externos. (Reproduzido da publicação ref. [107] , Copyright (2021), com permissão da Elsevier (código de 5157790417598).
A atividade antiproliferativa e antiangiogênica da artemisinina foi encontrada como um agente antimalárico natural nas células cancerígenas com toxicidade muito menor para as células normais. Ela tem aplicação limitada no tratamento do câncer devido à sua alta solubilidade lipídica, uma vez que atingir concentração terapêutica sem toxicidade para as células normais é difícil [108] . Recentemente, o polímero natural CS foi utilizado como agente de formulação para carregar artemisinina em MNPs. NPs de tamanho uniforme são feitos pela otimização das circunstâncias da formulação. As partículas representaram boa capacidade de carga de fármaco e um encapsulamento eficaz de fármaco com características magnéticas adequadas. A eficiência do encapsulamento de fármaco foi encontrada como 55%−62,5% junto com a capacidade de carga de fármaco de 20%−25%. Após 48 h, a artemisinina foi liberada (quase 62%−78%) dos MNPs de artemisinina. Em relação aos campos magnéticos externos fisiologicamente aceitáveis, um acúmulo melhorado de NPs foi demonstrado por MNPs de artemisinina conjugados com isotiocianato de fluoresceína (FITC) dentro dos tecidos tumorais de mama 4T1 do modelo de camundongos BALB/c [109] . Para maior carga de fármaco, liberação de fármaco mais específica e mais atividade anticâncer, a estratégia abaixo foi aplicada.
Adimoolam et al. estabeleceram uma formulação incluindo DOX conjugado a MNPs por meio de uma ligação imina sensível ao pH com glutaraldeído como um reticulador. Usando uma técnica de hidrólise simples, a síntese de várias quantidades de MNPs funcionalizados com CS foi realizada in situ em temperatura ambiente. Para as investigações de liberação de fármacos em pH de lisossomos e endossomos, os MNPs conjugados com DOX sintetizados foram utilizados em várias soluções tampão de pH. Os testes de viabilidade celular nas linhagens celulares SKOV3 e MCF7 revelaram que os MNPs conjugados com DOX representaram um impacto terapêutico melhorado em comparação com concentrações equivalentes do fármaco livre. Outra vantagem dos MNPs é sua toxicidade reduzida para as células normais como resultado de sua capacidade de direcionamento [110] .
A interação química reticulada entre o tereftaloil diisotiocianato sintético como agente de reticulação e as cadeias poliméricas de CS foi realizada por Eivazzadeh-Keihan et al. [111] . O hidrogel de CS reticulado tridimensional (3D) foi fabricado com alta estabilidade, porosidade e homogeneidade e então usado como o novo substrato para gerar um novo nanocompósito de CS reticulado com tereftaloil tioureia magnética. O desempenho do nanocompósito magnético projetado foi avaliado pelo processo de hipertermia de fluido magnético. A taxa de absorção específica (66,92 w/g) foi definida pela alternância do campo magnético (AMF) com um valor de magnetização de 78,43 emu/g.
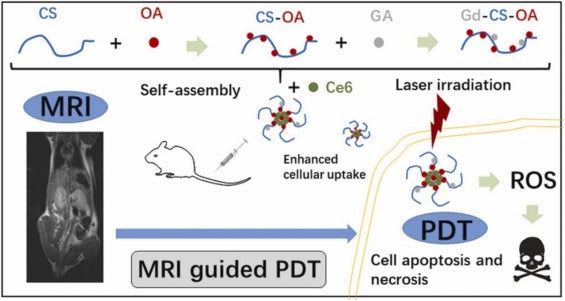
Recentemente, um polímero derivado de CS foi produzido com sucesso por Zhao et al. por meio da conjugação química de CS, ácido gadopentético (GA) e ácido octadecanóico (OA) ( Fig. 4 ). O Gd-CS-OA/Ce 6 alcançado representou uma capacidade de ressonância magnética melhorada com biocompatibilidade e estabilidade desejáveis. Além disso, o Gd-CS-OA/Ce 6 melhorou o Ce 6 absorção em 4 T 1 células em testes in vitro e in vivo. Gd-CS-OA/Ce 6 pode realizar PDT guiada por ressonância magnética em modelos com tumor e 4 T 1 células que representam vantagens anticâncer melhoradas em comparação com o Ce 6 livre. Assim, Gd-CS-OA/Ce 6 foi indicado como um DDS teranóstico capaz para tratamento eficiente do câncer [112] .

Figura 4 . A figura mostra a preparação, PDT guiada por ressonância magnética de Gd-CS-OA/Ce 6 e carregamento de medicamentos. (Reimpresso da publicação Ref. [112] , Copyright (2021), com permissão da Elsevier (código de licença;5157780028007).
2.5. Material magnético à base de metal para terapia do câncer
Os NPs baseados em metais têm tamanhos e formas diversos e foram estudados por seu papel na detecção e administração direcionada de medicamentos [113] , [114] . As características únicas dos NPs metálicos , por exemplo, alta relação entre área de superfície e volume, síntese química fácil, amplas características ópticas e fácil funcionalização da superfície são promissoras no campo biomédico para terapia do câncer [115] , [116] , [117] . Esses NPs também podem ser simplesmente funcionalizados com inúmeras frações, por exemplo, anticorpos, peptídeos, DNA ou RNA para atingir especificamente várias células [118] e com polímeros biocompatíveis para estender sua circulação in vivo para usos de administração de genes e medicamentos [119] , [120] . Além disso, eles poderiam efetivamente converter radiofrequência ou luz em calor, permitindo assim a ablação térmica do tumor [121] , [122] .
A excisão cirúrgica do tumor é uma abordagem terapêutica convencional contra metástases ósseas induzidas pelo câncer de mama; no entanto, pode causar defeitos ósseos e recorrência do câncer. Para superar esses problemas, Zhao et al. fabricaram o multifuncional GdPO 4 /CS/Fe 3 O 4 andaimes onde as nanorods de GdPO4 hidratadas foram organizadas nas matrizes magnéticas bioativas de CS para terapia fototérmica do câncer e regeneração óssea. O Fe3O4 NPs nos andaimes podem ser aplicados como agentes fototérmicos para oncoterapia, e os nanorods de GdPO 4 ·H 2 O amplamente arranjados podem promover habilidades de osteogênese e angiogênese. Sob a irradiação do laser NIR, as temperaturas locais ao redor do GdPO 4 /CS/Fe 3 O 4 os andaimes foram aprimorados para promover a apoptose das células tumorais e evitar a recorrência do câncer. Os novos vasos sanguíneos forneceram nutrientes e oxigênio para a osteogênese. Além disso, o GdPO4 nanorods nos scaffolds estimularam a via de sinalização BMP-2/Smad/RUNX2 que auxiliou a proliferação celular, diferenciação e regeneração do tecido ósseo. Assim, o novo GdPO 4 /CS/Fe 3 O 4 andaimes com função de cura de defeitos ósseos e terapia fototérmica de tumores podem se tornar uma plataforma auspiciosa para o tratamento eficiente de metástases ósseas de câncer de mama [123] .
Conjugados fotossensibilizadores e nanopartículas capazes de terapia fotodinâmica induzida por raios X (X-PDT) são um foco de pesquisa devido aos seus usos promissores na terapia do câncer. Jain et al. desenvolveram o nanocompósito magnético-luminescente Gd 2,98 Ce 0,02 Al 5 O 12 @mSiO 2 @rose bengal (GAG@mSiO 2 @RB) para ser usado como um agente X-PDT. O nanocompósito GAG@mSiO 2 @RB desenvolvido exibiu uma Transferência de Energia de Ressonância de Fluorescência (FRET) eficaz após o carregamento com RB devido à grande sobreposição espectral entre o RB e o GAG. Foi descoberto que a subexposição com raios X de baixa energia, o nanocompósito GAG@mSiO 2 @RB produziu 4 vezes mais oxigênio singlete . PDT eficaz de células MDA-MB-231 incubadas com nanocompósito GAG@mSiO 2 @RB foi obtido após irradiação com luz azul, comparando RB sozinho. O nanocompósito GAG@mSiO 2 @RB gerou ROS eficientemente após excitação com raios X. Além disso, devido à presença de Gd na estrutura cristalina da granada , o sistema nanocompósito sugerido indicou natureza paramagnética, que pode superar os problemas de penetração de luz restrita para teranósticos de câncer. Biocompatibilidade, não imunogenicidade, eficiência de fotoluminescência ótima e propriedades magnéticas sem quaisquer efeitos nocivos na ausência de luz, propõem o nanocompósito GAG@mSiO 2 @RB como um candidato atraente para suas aplicações. Esta nova nanoplataforma magnética-luminescente é promissora para usos futuros no diagnóstico e tratamento simultâneos de cânceres profundos [124] .
Os sistemas de administração de medicamentos (DDS) aumentam o potencial do medicamento em tratamentos por proteger os medicamentos da degradação rápida. MMSN não tóxicos foram aplicados para a liberação controlada de medicamentos e direcionamento. NPs de Fe3O4 @ mSiO2 foram modificados com ácido fólico ligado a polietilenoimina (PEI-FA) para aumentar sua solubilidade em água, bem como a especificidade para células tumorais ( Fig. 5 ). Portanto, o sistema de transporte de dissulfiram seletivo para câncer (DSF) (mMDPF) foi fabricado com uma proporção aprimorada de área de superfície para volume. A capacidade de carga do medicamento do mMDPF foi calculada como 4,35% via HPLC e a melhor cinética de liberação do medicamento do mMDPF foi detectada em pH 6,0 e 37 °C, que é o pH no endossomo. A citotoxicidade do mMDPF nas células MCF-7 foi aumentada usando o mMDPF com nitroprussiato de sódio ou cobre. Eles descobriram que o mMDPF foi absorvido mais usando células MCF-7 e sua toxicidade em células MCF-7 foi muito maior do que em células não tumorigênicas. Vantajosamente, alta solubilidade e especificidade, não toxicidade, morte seletiva de células cancerígenas, direcionamento e liberação controlável de medicamentos estão entre os benefícios que podem ser mencionados para este sistema de administração de medicamentos [125] .

Figura 5 . Diagrama esquemático da terapia seletiva direcionada ao câncer com NPs carregados com DSF mesoporoso magnético. (Reproduzido da publicação Ref. [125] , Copyright (2021), com permissão da Elsevier (código de licença; 5157780228470).
A detecção em estágio inicial é crucial para o tratamento eficaz do câncer. No entanto, um único modo de ressonância magnética é difícil de satisfazer as altas necessidades de diagnóstico preciso devido aos defeitos inatos. Jian-Hua et al. construíram um Fe 3 O 4 @MnO 2 @poliacrílico NPs (Fe 3 O 4 @MnO 2 @PAA) para o T 1 /T 2 responsivo ao pH terapia fototérmica guiada por ressonância magnética de modelo duplo. O Fe 3 O 4 núcleo forneceu Fe 3 O 4 @MnO 2 @PAA NPs com a capacidade de realização de agentes de contraste de ressonância magnética ponderada em T 2 , e nanoconchas de MnO 2 propuseram um grande potencial para ressonância magnética ponderada em T 1 responsiva ao pH. Este T 1 /T 2 responsivo ao pH A ressonância magnética de modelo duplo aumentou a especificidade e a sensibilidade e também ofereceu dados mais inclusivos para o diagnóstico de câncer. Além disso, os NPs de Fe 3 O 4 @MnO 2 @PAA mostraram ótimo desempenho fototérmico devido ao poderoso desempenho de absorção NIR, atingindo o objetivo de matar células tumorais sem prejudicar as células normais. Assim, foi revelado que este nanocompósito pode ser um agente teranóstico responsivo ao pH esperançoso para oferecer informações precisas e detalhadas para a detecção e tratamento do câncer [126] .
2.6. Materiais magnéticos à base de carbono para terapia do câncer
Nos últimos anos, os nanomateriais à base de carbono estão atraindo muita atenção devido à sua capacidade de operar como uma plataforma para anexar ligantes ou medicamentos [127] . Modelos simples são frequentemente aplicados em estudos de câncer, nos quais os nanomateriais de carbono são conjugados a um ligante que é particular a um receptor superexpresso para administração de medicamentos e geração de imagens na terapia do câncer. [128] , [129] . Esses nanomateriais de carbono apresentam características únicas para o veículo de entrega ou imagem devido às suas altas qualidades de fluorescência e sua natureza não tóxica [130] . Analisamos a seguir estudos publicados recentemente sobre materiais baseados em carbono magnético para terapia do câncer.
Recentemente, os impactos terapêuticos da irradiação NIR em células A549 resistentes a DOX foram avaliados e as investigações in vivo equivalentes foram conduzidas para avaliar o comportamento das substâncias sintetizadas em tratamento quimio/fototérmico direcionado (quimio-PTT). NPs de Fe 3 O 4 @carbon@DOX funcionalizados com aptâmero (Apt-Fe 3 O 4 @C@DOX) foram relatados para quimio-PTT sinérgico de câncer ( Fig. 6 ). Pela excelente capacidade de direcionamento ativo de tumores de NPs de Apt-Fe 3 O 4 @C@DOX, o reconhecimento simultâneo de tumores alvo foi permitido por meio de imagens de RM. Com base no ensaio de citotoxicidade in vitro, o quimio-PTT integrado é ainda mais tóxico para as linhagens de células A549 em comparação com o PTT ou o agente quimioterápico sozinho. A terapia explicada reduziu as taxas de crescimento tumoral, embora existisse até mesmo quantidades baixas de DOX. Isso provavelmente é causado pela geração de calor intracelular induzida pelo efeito fototérmico. Ele diminui o metabolismo de DOX e incrementa o acúmulo de DOX em células tumorais. Tais resultados revelaram que a terapia combinada quimio-PTT proposta pode obter alta eficiência terapêutica contra tumores baseados em A549 com excelente biocompatibilidade [131] .

Figura 6 . Ilustração esquemática da preparação de Apt-Fe 3 O 4 @C@ DOX NPs e internalização de Apt-Fe 3 O 4 @C@DOX NPs em células tumorais para tratamento combinado quimiofototérmico. (Reproduzido da publicação Ref. [131] , Copyright (2021), com permissão da Elsevier (código de licença; 5157780336267).
Ainda é desafiador entregar através da BBB e atingir os tumores cerebrais como o glioblastoma [132] . Portanto, novas abordagens terapêuticas e veículos de entrega de fármacos são intensamente procurados. A este respeito, Wu et al. [131] mudou o conceito de partícula anteriormente apresentado e fez um ferrofluido aquoso livre de surfactante. Ele compreendia SPIONs cobertos com conchas de carbono e mesocamadas de silicato. A dupla cobertura em SPIONs influenciou inúmeras características biológicas e físico-químicas, como eficácia de direcionamento de câncer e estabilidade coloidal. NPs reduziram a viabilidade de tumores de osteossarcoma e glioblastoma comparando seus análogos primários e não transformados. Uma melhor preferência foi representada por células cancerosas como resultado de uma taxa de absorção aumentada das células e aderência perceptível à membrana da célula tumoral. Calor suficiente foi gerado por NPs mesmo em um campo magnético alternativo ultrabaixo para levar à morte do tumor. Nos compartimentos basolaterais, NPs foram encontrados. Além disso, a avaliação de LAMP1 revelou que os NPs atravessaram a BBB transcelular e escaparam do lisossomo enquanto se localizavam nos lobos ópticos dos cérebros larvais de terceiro instar de Drosophila melanogaster . A passagem não invasiva resultou em baixos impactos sistêmicos adversos aos animais. Deduz-se que tais ferrofluidos nanoparticulados se ligam às células cancerígenas e, portanto, revelam maior toxicidade nessas células em comparação às células primárias. Portanto, eles têm maior eficácia in vitro contra tumores sólidos e podem percorrer a BBB em Drosophila. Essas partículas também não são tóxicas de acordo com os estudos em evolução em moscas cultivadas em meios infundidos com ferrofluido [131] .
Houve um grande interesse em novos NPs multifuncionais de núcleo-casca como resultado de seus grupos funcionais abundantes e propriedades de superfície fáceis de modificar. Recentemente, os NPs Ag@Fe 3 O 4 @C-PEG-FA foram sintetizados com estrutura regular, tamanho uniforme e maiores capacidades de carga de DOX. Vantajosamente, os NPs Ag@Fe 3 O 4 @C-PEG-FA/DOX sintetizados tiveram bons impactos fototérmicos e liberação de DOX melhorada pela irradiação de luz de 808 nm. Além disso, os NPs Ag@Fe 3 O 4 @C-PEG-FA/DOX possuíam excelente biocompatibilidade, estabilidade, tratamento sinérgico e direcionamento de células cancerígenas sem quaisquer efeitos colaterais tóxicos nos animais tratados. Uma capacidade superior é fornecida pelo PEG multi-armado nas bordas dos NPs Ag@Fe 3 O 4 @C para os materiais para carga de DOX. Como resultado da capacidade superior de absorção do infravermelho próximo (NIR) da camada de carbono, ela pode ser utilizada como um fototérmico, Fe 3 O 4 foi empregado como reagente para ressonância magnética. Especificidades de imagem multimodal foram incluídas para imagens DOX FL e imagens de ressonância magnética aprimoradas por T 2 na área do tumor e um impacto inibitório decente no crescimento do tumor tratamento quimio/fototérmico sinérgico. Não houve efeitos colaterais óbvios e toxicidade nos animais controle e tratados. Portanto, os NPs Ag@Fe 3 O 4 @C-PEG-FA são nanoplataformas perfeitas para terapia quimio/fototérmica e imagens multimodelo [133] .
2.7. Materiais magnéticos modificados por PEG para terapia do câncer
Materiais baseados em PEG, como candidatos promissores para terapia direcionada de vários tipos de câncer, podem se automontar em NPs no meio aquoso e oferecer uma superfície furtiva que pode diminuir o reconhecimento do sistema reticuloendotelial (RES) de NPs e pode estender o tempo de circulação sanguínea [134] . Em teoria, os NPs anfipáticos montados em PEG podem não ser opsonizados e permanecer na circulação sanguínea até penetrarem nas vasculaturas permeáveis do tumor. [118] , aumentando assim a possibilidade de atingir seu local de ação. A incorporação de uma pequena parte de material anfifílico à base de PEG diminui a captação e a opsonização do RES, aumenta a hidrofilicidade da superfície e o tempo de circulação do lipossomo que contribui para aumentar a concentração do fármaco no derrame maligno [135] , [136] . Assim, nanomateriais anfifílicos baseados em PEG desempenham um papel fundamental em terapias de direcionamento passivo. Aqui, analisamos estudos publicados recentemente de materiais modificados por PEG magnético para terapia de câncer.
Um copolímero enxertado com polissuccinimida (PSI) foi sintetizado como um precursor de polímero reticulado para a fabricação de MNPs reticulados biodegradáveis e biocompatíveis. Os MNPs foram cobertos com o PSI anfifílico enxertado com cadeias de PEG conjugadas com alquila e folato. Sobre a camada interna dos NPs, as unidades de succinimida foram reticuladas e transformadas em uma estrutura biodegradável e biocompatível compreendendo ligações amida . Elas foram mais utilizadas para tolerar grupos amina livres na superfície de MNPs reticulados (CMNPs). Por fim, os CMNPs foram conjugados com o corante fluorescente de infravermelho próximo (NIR) Cy5.5 para aplicação em ressonância magnética ou usos de imagem óptica direcionados ao câncer. Os CMNPs conjugados com folato e Cy5.5 resultantes tinham um diâmetro de aproximadamente 45 nm, representando uma adequação brilhante e um T 2 mais alto coeficiente de relaxividade. Com base nos estudos in vivo e in vitro, a eficácia potencial de CMNPs-Cy5.5-fol é demonstrada como sondas de imagem dupla para usos específicos de imagem NIR/MR direcionados ao câncer. As vantagens dos CMNPs incluem biocompatibilidade, biodegradabilidade, excelente estabilidade estrutural in vivo e multifuncionalidade, direcionamento específico ao câncer e modalidades de imagem dupla [137] .
Atualmente, os anticorpos monoclonais são utilizados para o tratamento de inúmeras doenças, incluindo o câncer [138] . Em relação à administração de medicamentos específicos direcionados ao tumor, há inúmeros esforços para fazer NPs conjugados a anticorpos que podem mostrar efeito terapêutico altamente aprimorado em diferentes tipos de câncer. [139] . Geralmente, tanto CD133 quanto CD44 são aceitos como marcadores de células-tronco de câncer gástrico. Em um estudo recente, células-tronco de câncer gástrico foram direcionadas via NPs de PLGA-lecitina-PEG carregadas com ácido all-trans-retinóico conjugado a anticorpos CD133 e CD44 (ATRA-PLPN) (Fig. 8). Seus efeitos terapêuticos foram examinados contra células-tronco de câncer gástrico e os resultados provaram a entrega eficiente e especial de CD133/CD44 para células-tronco de câncer gástrico CD44++ e CD44++ ou CD133. Portanto, os efeitos inibitórios do crescimento foram aprimorados para células-tronco de câncer gástrico em comparação com NPs de alvo único e não alvo. O presente trabalho relatou a elevação da entrega de NPs para dois grupos de células-tronco de câncer gástrico por meio de anticorpos. Normalmente, o câncer inclui grupos distintos de células-tronco cancerígenas com muitos fenótipos. Portanto, nossos NPs de alvo duplo criam plataformas de entrega de medicamentos eficientes para atingir inúmeras populações de células-tronco cancerígenas no câncer. Alvo eficaz e específico, biodistribuição aumentada e endocitose aprimorada de NPs em células tumorais são alguns benefícios desta plataforma de administração de medicamentos. No entanto, devido ao baixo número de células-tronco do câncer gástrico na massa tumoral, a imagem óptica do direcionamento de CD44/CD133-ATRA-PLPN para células-tronco do câncer gástrico in vivo é difícil [140] .
Recentemente, microcápsulas compostas de polímero Fe 3 O 4 com diâmetro normal de 885,6 e 587 nm foram apresentadas para cirurgia de ultrassom focalizado guiada por ressonância magnética (RM) (MRgFUS) [141] , [142] . Eles podem aumentar a deposição de energia e a absorção de ondas ultrassônicas no tecido alvo, portanto, os impactos ablativos do tumor do MRgFUS são aumentados [141] . A criação de um alvo ativo PEGilado Fe 3 O 4 A plataforma NPs foi demonstrada. O anti-EGFR foi usado para decorar as superfícies de NPs de Fe 3 O 4 PEGilados , para entrega guiada ao câncer de fígado via superexpressão de EGFR . Além disso, com base nos estudos de captação celular in vitro e citotoxicidade para células Hep G2, a endocitose habilitada pelo receptor EGFR pode aumentar o Fe 3 O 4 PEGilado Taxa de absorção de NPs. Assim, o alvo estabelecido PEGilado Fe 3 O 4 O sistema NPs pode possuir excelente potencial para a terapia de ressonância magnética do câncer de fígado [143] .
IONPs podem ser coletados nos tecidos tumorais devido ao seu magnetismo excepcional. Essas partículas são agentes de contraste T 2 encontrados por meio de ressonância magnética para monitorar seu acúmulo tumoral. Com base em estudos anteriores, as células cancerosas produziram peróxido de hidrogênio (H 2 O 2 ) a uma velocidade de 0,5 nmol·10 células por hora [144] . A PDT como uma modalidade de terapia contra o câncer aprovada pela FDA utiliza fotossensibilizador não tóxico, O 2 , e ROS citotóxicos geradores de luz, principalmente O 2 para a maioria dos fotossensibilizadores típicos para danificar células cancerígenas por oxidação . No entanto, a capacidade inadequada de direcionamento de tumor do O 2 e fornecimento de fotossensibilizadores dentro do tumor sólido, a faixa de difusão restrita de O 2 e o curto tempo de vida limitam poderosamente a eficiência da PDT. Para a administração de ftalocianina de zinco (ZnPc), os IONPs foram carregados dentro da estrutura de automontagem semelhante a estomatócitos de poli(etilenoglicol)-bloco-poliestireno (PEG- b -PS) como nanomotores para transferir fotossensibilizadores para os tecidos tumorais e aumentar a eficiência da PDT. Sob campo magnético, os nanomotores híbridos (estomatócitos carregados com NPs de óxido de ferro @ nanomotores de ZnPc, chamados de ISP-NMs) podem ser coletados em tecidos cancerígenos como resultado do magnetismo dos IONPs. Após a captura pelas células cancerígenas, a decomposição de H 2 O 2 endógeno pode ser catalisada por IONPs gerando O 2 como a força propulsora para o movimento dos ISPNMs. A distribuição de ZnPc foi expandida pelas características de movimento dos ISP-NMs, ampliando a distribuição reativa de ROS e melhorando a atividade PDT. Além disso, o O 2 criado pode ser entregue para o procedimento PDT garantindo seu ótimo desempenho. Além disso, os ISP-NMs possuíam uma função de ressonância magnética nuclear porque os IONPs são T 2 eficazes agentes de contraste ( Fig. 7 ) [145] .

Figura 7 . Ilustração esquemática do direcionamento do tumor assistente de campo magnético de ISP-NMs e seus 1 O 2 produção e procedimento PDT para terapia do câncer. (Reproduzido da publicação Ref. [145] , Copyright (2021), com permissão da Elsevier (código de licença; 5157780493034).
Uma vez que uma estratégia eficaz é fornecida pela integração de PTT com imunoterapia na terapia do câncer, um sistema de entrega de MNPs foi feito para carregar o hidrocloreto de R837 imunoestimulatório (R837) e o verde de indocianina (ICG) para sinergismo espaçotemporal de imunoterapia/PTT no câncer. Tal sistema de entrega compreende PEG como a camada de revestimento para carregar R837 e Fe 3 O 4 MNPs como o núcleo para carregar ICG. Usando injeção intravenosa, o revestimento DPA-PEG levou à longa circulação, e a magnetização superparamagnética, a função PA e PTT da Medical Internal Radiation Dose (MIRD) potencializou a imagem multimodal fotoacústica/fototérmica e o direcionamento magnético. Aqui, impactos profiláticos e terapêuticos potentes com poucos efeitos colaterais foram demonstrados sistematicamente. Vantajosamente, a sinergia da imunoterapia e PTT pode prevenir o crescimento tumoral, a recorrência e a metástase. Portanto, impactos terapêuticos anticâncer potentes foram resultantes, representando uma nova área promissora e aberta para pesquisas futuras [146] .
2.8. Polímeros magnéticos biocompatíveis para terapia do câncer
O desenvolvimento de NPs baseados em polímeros biodegradáveis e biocompatíveis, por exemplo, poli(ácido láctico) e poli(ácido glicólico), e seus copolímeros são de grande interesse para os pesquisadores. Mesmo sendo sintéticos, esses polímeros são degradados no corpo em monômeros e oligômeros que são mais removidos pelas vias metabólicas normais, como o ciclo de Krebs [147] , [148] , [149] , [150] . Uma vez que os NPs de polímero são administrados intravenosamente, eles são submetidos à reação de opsonização, que causa sua fagocitose através dos monócitos-macrófagos. Para superar esse problema, as partículas podem ser revestidas com polímeros hidrofílicos , por exemplo, PEG, o que evita o reconhecimento dos NPs usando o sistema reticuloendotelial [151] , [152] . Exemplos recentes de polímeros biocompatíveis usados para terapia do câncer são revisados abaixo.
Um novo copolímero anfifílico termo- e sensível ao pH enxertado MNPs foi projetado e sintetizado contendo bloco de PLA biodegradável e hidrofóbico e seção de P hidrofílico (NIPAAm- co -HEMA- co -MAA- co -TMSPMA) por meio de uma combinação de polimerização de radicais livres e abordagens de abertura de anel. Dois medicamentos anticâncer MTX e DOX foram simultaneamente carregados em nanocompósito para objetivos de quimioterapia combinada contra o câncer . A liberação simultânea de DOX/MTX mostrou comportamento de liberação auxiliado por nicho tumoral (pH≤5,4 e temperatura=41 °C). Os achados de citotoxicidade revelaram a não toxicidade do nanocompósito recém-desenvolvido para linhas de células MCF7. A característica antitumoral do nanocompósito carregado com DOX/MTX foi maior do que os medicamentos livres descobertos pela coloração de 4',6-diamidino-2-fenilindol (DAPI), ensaio de MTT, RT-PCR e análise do ciclo celular em linhas de células MCF-7. Os resultados expuseram que este nanocompósito projetado pode ser utilizado com sucesso na administração direcionada de MTX e DOX aos tecidos tumorais e para mais aplicações in vivo e clínicas. Biodegradabilidade, biocompatibilidade, não toxicidade, liberação direcionada do fármaco, estabilidade na corrente sanguínea e proficiência para manter o fármaco contra a decomposição in vivo são alguns benefícios do nanocompósito projetado usado neste estudo [153] .
Em outro estudo, MNPs revestidos com poli- L- lisina biocompatíveis foram relatados para a ressonância magnética combinada e a hipertermia magnética para unificar o método diagnóstico e terapêutico. Neste estudo, MNPs modificados com amino biocompatíveis foram conjugados a anticorpos específicos. Em seguida, as amostras foram expostas a medições de calorimetria . De acordo com as taxas de aquecimento aproximadas, as taxas de absorção específicas para os MNPs modificados com poli- L- lisina (MFPLL) foram estimadas. Os valores da taxa de absorção específica (SAR) computada são apropriados para o estudo futuro que se concentra na detecção de células cancerígenas mediadas com anticorpos e na terapia em combinação com hipertermia e ressonância magnética. Os resultados obtidos mostraram o efeito importante da MFPLL no tempo de relaxamento transversal T 2 com a relaxividade r 2 igual a 487,94 mM. Descobriu-se que a combinação significa um avanço substancial na terapia da doença do câncer e um aumento significativo na sobrevivência dos pacientes oncológicos. Os resultados revelaram a ligação específica do anticorpo conjugado MFPLL à proteína anidrase carbônica IX (CA IX) em cultura esferoidal tridimensional. Pesquisas anteriores revelaram características de internalização do receptor induzidas por anticorpos do Mab VII/20 [154] que podem ser cruciais para a entrega de conjugados em células cancerosas e o uso provável deste conjugado é a terapia anticâncer combinada. A principal vantagem do MFPLL é o direcionamento seletivo de células de câncer colorretal que pode ser importante para o possível uso desta terapia anticâncer combinada conjugada [155] .
Um hidrogel natural magnético sensível ao pH foi desenvolvido como um sistema eficaz de administração de medicamentos para o tratamento do câncer. O alginato (Alg) foi primeiramente oxidado, depois, a gelatina (Gel) foi reticulada com Alg para produzir o hidrogel químico Alg-Gel por meio de uma reação de condensação “Shift-Base”. Então, NPs de Fe 3 O 4 foram integrados ao hidrogel por meio de um método de coprecipitação química in situ. O Alg-Gel/Fe 3 O 4 obtido foi carregado com DOX, e as eficiências de encapsulamento, sua carga de fármaco e sua atividade anticâncer foram estudadas contra células Hela. Em pH = 4 (condição ácida), o Alg-Gel/Fe 3 O 4 -DOX mostrou um valor de liberação de fármaco maior do que aqueles de pH 7,4 e 37 °C (condição fisiológica). Ele mostrou que o hidrogel magnético construído tem um potencial brilhante como um sistema de administração de fármacos (DDS) para a quimioterapia do câncer, principalmente devido ao seu maior desempenho do que aqueles do DOX livre em termos de comportamento de liberação de fármaco dependente de pH, perfil de liberação lenta de fármaco, característica magnética para diagnóstico por ressonância magnética e isolamento na área alvo. Com base nos resultados, o Alg-Gel/Fe 3 O 4 O hidrogel magnético pode ser estudado como um DDS inteligente para diagnóstico e terapia de câncer. As vantagens do Alg-Gel-DOX e do Alg-Gel/ Fe 3 O 4 -DOX sobre o DOX livre incluem baixa toxicidade, alta biodistribuição, liberação lenta do fármaco e baixa degradação do fármaco [156] .
Zhang et al. desenvolveram com sucesso NPs multifuncionais encapsulados com NPs superparamagnéticos de Fe 3 O 4 . O medicamento olaparib (Olb) foi carregado e a formulação foi usada para o tratamento multimodal do câncer de mama triplo-negativo. O ácido hialurônico (AH) de baixo peso molecular foi escolhido para revestir NPs. Devido à alta afinidade entre o receptor CD44 na superfície celular do câncer de mama triplo-negativo (TNBC) e o ácido hialurônico, um direcionamento eficaz pode ser alcançado para aplicar os efeitos antitumorais sinérgicos tanto in vivo quanto in vitro. Usando tratamento de campo magnético rotativo (RMF), HA-Olb-PPMNPs (NPs poliméricos multifuncionais) geraram uma transferência física de força mecânica com uma rotação imperfeita que as forças de cisalhamento geradas pela rotação, portanto, feriram os lisossomos e interromperam a integridade da membrana celular após HA-Olb-PPMNPs internalizarem nas células, pelo qual efeitos prejudiciais de “dois golpes” foram evidentes por meio de microscopia confocal de varredura a laser (CLSM) e microscópio eletrônico de varredura (SEM) ( Fig. 8 ). Portanto, Olb e a força mecânica aplicam efeito antitumoral duplo para atingir terapêutica sinérgica na presença de RMF. Portanto, a excitação magnética por meio de força mecânica oferece uma abordagem empolgante para controlar remotamente as funções celulares para terapia do câncer [157] .

Figura 8 . Ilustração esquemática do dano celular visualizado por SEM e TEM. (A) Ilustração dos mecanismos anticâncer de magneto-célula-apoptose e magneto-célula-lise (B) As imagens SEM da integridade da membrana celular danificada usando a ação dos HA-PPMNPs/HA-Olb-PPMNPs ativados pela terapia RMF (seta vermelha). (C) Imagens TEM ilustrativas de magneto-célula-apoptose desencadeada por HA-PPMNPs/HA-Olb-PPMNPs sob tratamento RMF (seta azul: corpos apoptóticos, seta amarela: bolhas intracelulares e seta verde: cariorrexe e cariopicnose. (Reproduzido da publicação Ref. [157] , Cpyright (2021), com permissão da Elsevier (código de licença; 5157780661963).
2.9. Outros materiais magnéticos para terapia do câncer
Teranósticos baseados em NPs surgiram rapidamente na última década e têm sido amplamente utilizados no diagnóstico e tratamento de alguns tumores, como câncer de mama e câncer de fígado. No entanto, há descobertas limitadas para cânceres de pele. Hou et al. sintetizaram com sucesso NPs multifuncionais de CS-Fe 3 O 4 enxertados com IR820 (por meio da grade de IR820 na superfície de óxido de ferro magnético revestido com CS) para usos teranósticos em melanoma . Esta nanopartícula teranóstica mostra uma excelente capacidade de ressonância magnética e efeitos citotóxicos contra melanoma sob irradiação com um laser infravermelho próximo in vitro. Além disso, eles têm citotoxicidade insignificante e alta estabilidade na solução aquosa, até 8 dias. Devido às propriedades únicas, o IR820-CS-Fe 3 O 4 NPs ofereceram um efeito citotóxico perceptível em células A375 após a irradiação sob um laser NIR do que PDT convencional. Os resultados mostraram o bom potencial de IR820-CS-Fe 3 O 4 NPs para o diagnóstico e tratamento do melanoma [158] .
Partículas magnéticas bacterianas biomineralizadas (BMPs) têm sido extensivamente pesquisadas para usos biomédicos com suas características magnéticas e uma camada de biomembrana. BMPs têm sido utilizadas para administração de medicamentos com alvo magnético, hipertermia magnética, imagens de RM, detecção magnética e separação [159] , [160] , [161] . As vantagens dos BMPs sobre os MNPs incluem boa dispersão, grande produção, alta cristalinidade e magnetização próxima ao volume [159] , [162] . Wang et al. aplicaram pela primeira vez BMPs para terapia fototérmica direcionada magneticamente de tumores in vivo. As BMPs foram inoculadas no tecido tumoral pelo ímã bipolar constante em forma de C autoconstruído com um grande campo magnético gradiente no local do tumor. Para o experimento simulado in vitro, as BMPs tiveram uma grande taxa de manutenção na área direcionada magneticamente com diversas taxas de fluxo. Com o direcionamento magnético, as BMPs inoculadas com irradiação de luz NIR para a terapia fototérmica podem causar uma erradicação completa do tumor. Ele oferece um método eficaz para os usos biomédicos de BMPs [163] .
Nos últimos anos, a combinação sinérgica da tecnologia de plasma e do sistema de administração quimioterápica de NPs demonstrou sua capacidade no tratamento do câncer [164] . As vantagens únicas do CAP, incluindo esterilização, cura da madeira, coagulação sanguínea, clareamento dentário, regeneração da pele e terapia do câncer, auxiliaram os usos biomédicos recentes [165] , [166] , [167] , [168] , [169] , [170] , [171] . No entanto, não existe nenhum relatório sobre CAP combinando MNPs baseados em óxido de ferro. O impacto do co-tratamento dos MNPs baseados em óxido de ferro e plasma atmosférico frio (CAP) foi relatado tanto in vivo quanto in vitro para a terapia direcionada ao câncer de pulmão. A este respeito, os impactos sinérgicos dos MNPs baseados em óxido de ferro e CAP na expressão de EGFR, bioatividade celular e vias de sinalização a jusante do EGFR foram estudados ( Fig. 9 ). Os resultados revelaram que o co-tratamento dos MNPs baseados em óxido de ferro e CAP pode evitar eficientemente a proliferação celular por meio da redução da viabilidade e indução de apoptose. Na vivo cenário revela que o CAP combinando MNPs é útil na supressão de tumores xenograftados. Portanto, a combinação de CAP e MNPs baseados em óxido de ferro oferece uma ferramenta promissora para o desenvolvimento de uma nova abordagem de terapia do câncer [172] .

Figura 9 . Ilustração esquemática dos mecanismos moleculares de MNPs aumentando o impacto da morte seletiva de tumores do CAP. Espécies reativas originadas do CAP resultarão em um aumento significativo de H 2 O 2 intracelular, Fe 2+ /Fe 3+ liberado do lisossomo que compreende MNPs pode catalisar H 2 O 2 em OH, o que resulta em danos às células do carcinoma , por exemplo, causando apoptose induzida por mitocôndrias e quebras de DNA de fita dupla. (Reproduzido de Ref. [172] , Copyright (2021), com permissão da Elsevier (código de licença; 5157780788522).
Munir et al. demonstraram pela primeira vez que os agentes de encapsulamento aumentam o poder de magnetização enquanto diminuem o tamanho das partículas também. Neste estudo, a síntese de NPs de óxido de ferro não encapsulados e encapsulados com ácido málico (MA) e ácido cítrico (CA) foi feita pela abordagem de coprecipitação . Para o bioensaio in vivo, os MNPs encapsulados foram inoculados dentro das células tumorais seguidos pela exposição a campos magnéticos alternados. Em geral, os resultados mostraram a melhor adequação dos NPs de óxido de ferro encapsulados com MA e CA para tratar o câncer de mama em camundongos por meio da terapia de hipertermia. A exposição ao campo magnético alternado (AMF) de 15 mT e à frequência de 100 kHz por 1 h resultou em um aumento na temperatura (de 37 para 48 o C) e também causou lesão celular e morte celular apoptótica subsequente. No geral, os NPs de Fe 3 O 4 funcionalizados mostraram uma redução no tamanho das partículas, características aprimoradas e eficiência aprimorada para terapias de carcinoma por hipertermia. Portanto, os NPs de óxido de ferro com revestimento de CA reivindicam resultados significativos que podem ser muito úteis no futuro para superar as enormes baixas devido ao câncer cervical/de mama.
A terapia nanocatalítica em desenvolvimento pode catalisar in situ as substâncias endógenas em espécies muito tóxicas e então efetivamente matar as células tumorais, no entanto, a falta de nanocatalisadores de alto desempenho dificulta sua ampla tradução clínica. Pela primeira vez, Dai et al. desenvolveram com sucesso NPs de ferro-polivinilpirrolidona cristalizadas de valência zero nanométricas (NPs nZVCI-PVP) para causar reação de Fenton nanocatalítica in situ dentro de TME para gerar grandes quantidades de radicais hidroxila e então matar as células tumorais, que podem ser aumentadas mais sinergicamente por hipertermia magnética ou fotônica, auxiliadas por esses NPs de ferro atuando como nanoagentes de conversão magnetotérmica ou fototérmica, respectivamente ( Fig. 10 ). Este estudo não apenas oferece um novo tipo de NPs à base de ferro para uso biomédico, mas também revela a alta eficácia do tratamento nanocatalítico do câncer auxiliado por hipertermia magnética e fotônica. [173] .

Figura 10 . A figura mostra o nZVCI-PVP para tratamento nanocatalítico sinérgico guiado por imagem de RM ponderada em T2 in vivo e hipertermia fotônica e magnética de câncer. (a) modificação de PVP de superfície de NPs nZVCI, (b) funções de imagem de RM de NPs nZVCI-PVP, (c) tratamento nanocatalítico sinergicamente aumentado e ablação fototérmica de tumor (d) tratamento nanocatalítico sinergicamente aumentado e ablação magnética de tumor auxiliados pelo uso de NPs nZVCI-PVP. (Reproduzido da publicação Ref. [173] , com permissão da Elsevier (código de licença; 5157780928927).
3. Conclusões e perspectivas futuras
Os MNPs mostram grande promessa para aplicação como um intensificador de contraste de imagem e agente terapêutico para cânceres que são convencionalmente tratados pela combinação de quimioterapia, radioterapia e ressecção cirúrgica. Além disso, os MNPs mostram grande potencial para utilização no monitoramento de tratamentos de câncer e podem fornecer dados críticos para médicos, permitindo que eles adaptem abordagens de tratamento para oferecer o cuidado ideal. Os MNPs têm visto um amplo progresso por equipes de pesquisa no mundo, ainda assim, formulações limitadas foram aprovadas para aplicações clínicas. Muitas tentativas de desenvolver MNPs para teranósticos de câncer continuaram inabaláveis. Existem alguns estudos clínicos em andamento aplicando MNPs para a terapia de hipertermia de diferentes tipos de câncer. Além disso, as equipes de pesquisa continuam a otimizar os procedimentos de síntese para a funcionalização de MNPs por um agente bioterapêutico, quimioterápico e contraste de imagem. A tradução de MNPs do laboratório para a clínica precisa de uma compreensão completa dos efeitos que os parâmetros de MNPs têm nas respostas biológicas do ser humano. Muitas formulações de MNP falharam em produzir níveis aceitáveis de tratamento em grandes animais e humanos; como o que foi observado em modelos de pequenos animais. Para aumentar a taxa de sucesso da tradução de MNPs para a clínica, as tentativas devem ser concentradas em aumentar a capacidade de carga de fármacos, aumentando sua afinidade e especificidade para células tumorais alvo e obtendo capacidade na liberação de fármacos dependente do microambiente. Além disso, prever a melhor formulação de MNPs para humanos é alcançado com a ajuda de melhores modelos animais teóricos. À medida que nossa compreensão da natureza dos MNPs aumenta, temos esperança de que a combinação de imagens e tratamento multimodal com MNPs impulsionará seus usos clínicos e afetará significativamente o tratamento de cânceres em um futuro próximo. Tabela 1 limita algumas características dos materiais magnéticos relatados para terapia do câncer.
Tabela 1 . Resumo dos materiais magnéticos relatados para terapia do câncer.
| Material | Alvo | Característica específica | Vantagens e/ou limitações | Ref. |
|---|---|---|---|---|
| SPIONs revestidos com ácido poliacrílico | células tumorais da mama | anticorpo anti-HER2 | Vantagens: Alta estabilidade, tamanho ultrapequeno e resistência à agregação | [41] |
| Célula vazia | Limitação: reduzir o efeito comumente visto no aquecimento relacionado ao relaxamento browniano | |||
| Nanopartículas PLGA carregadas com SPIONs/Cur/Ver | Câncer de fígado HepG2 | Encapsulamento PLGA | Vantagens: Estabilidade melhorada, toxicidade minimizada e eficiência de tratamento maximizada | [45] |
| SPION revestido com PCL | células tumorais do fígado humano | SPIONs revestidos de polímero | Vantagens: estabilidade estrutural, melhor dispersibilidade e citocompatibilidade | [49] |
| SPION-porfirina conjugada com TZ | MCF 7 | Nanopartículas conjugadas com anticorpos | Vantagens: Baixa citotoxicidade e solubilidade em água | [53] |
| SPIONs encapsulados em PA | células cancerígenas | conjugado com biotina | Vantagens: boa capacidade de aquecimento e maior capacidade de absorção de células cancerígenas | [54] |
| Célula vazia | Limitação: alta citotoxicidade | |||
| FA-EuGd-MSNs-SS- L -cisteína (Cys) | Células Hela | Segmentação de FA | Vantagens: Baixa citotoxicidade, alta estabilidade, diagnóstico e tratamento simultâneos | [68] |
| MnSiO 3 @Fe 3 O 4 | Célula HeLa | – | Vantagens: Toxicidade reduzida e monitoramento em tempo real da liberação do medicamento | [73] |
| FA-Gd-Tb@SiO 2 | Células tumorais | – | Vantagens: Nanofármaco favorável, multifuncional e de tamanho controlado, excelente efeito fototérmico e excelente desempenho de resposta ao pH na liberação e carregamento do fármaco | [76] |
| Esferas IONP encapsuladas por CTAB | Células HeLa | – | Vantagens: Geração simples em larga escala, tamanho de poro uniforme ajustável, alta área de superfície e grandes volumes de poros | [67] |
| Célula vazia | Limitação: Tóxico em alta concentração de CTAB | |||
| Nano-drogas Fe 3 O 4 @SiO 2 @DOX | Células tumorais pulmonares A549 | – | Vantagens: efeito quimio/fototérmico sinérgico excepcional e alta citotoxicidade e captação celular | [77] |
| Apt -Au- Fe3O4 | Células tumorais ovarianas SKOV-3 | aptâmeros funcionalizados | Vantagens: grande afinidade de ligação, tamanho pequeno, alta especificidade e não imunogenicidade | [84] |
| Célula vazia | Limitação: Seletividade limitada que os restringe na segmentação celular e na liberação exata de aptâmeros | |||
| MGN@Ce 6 @RT | Tumores TNBC | cRGD/TPP dupla segmentação | Vantagens: Excelente biocompatibilidade, identificação e tratamento altamente eficientes e precisos de TNBCs | [99] |
| Gd-CS-OA/Ce 6 | Células 4T1 | – | Vantagens: biocompatibilidade e estabilidade desejáveis | [112] |
| GdPO4 / CS / Fe3O4 | metástases ósseas de câncer de mama | – | Vantagens: Aumento da apoptose e evita a recorrência do câncer | [123] |
| Célula vazia | Limitação: Baixa solubilidade em água | |||
| GAG@ mSiO2 @RB | cânceres profundos | – | Vantagens: Biocompatibilidade, não imunogenicidade e alta eficiência de fotoluminescência | [124] |
| Apt - Fe3O4 @C@DOX | Células A549 | funcionalizado por aptâmero | Vantagens: Excelente biocompatibilidade, alta eficiência terapêutica, excelente capacidade de direcionamento de tumores ativos | [131] |
| Ag@ Fe3O4 @C- PEG -FA/DOX | Células tumorais | PEG multi-armado | Vantagens: Bons impactos fototérmicos e liberação de DOX melhorada, excelente biocompatibilidade e estabilidade | [133] |
| CD44/CD133-ATRA-PLPN | câncer gástrico | ATRA-PLPN conjugado com anticorpo | Vantagens: direcionamento eficaz e específico, aumento da biodistribuição e endocitose aprimorada de NPs em células tumorais | [140] |
| Célula vazia | Limitações: A dificuldade de obtenção de imagens ópticas devido ao baixo número de células-tronco do câncer gástrico na massa tumoral | |||
| NPs magnéticos revestidos com poli- L -lisina (MFPLL) | células cancerígenas colorretais | conjugação com anticorpos específicos | Vantagens: Segmentação seletiva | [154] |
| Alg-Gel/ Fe3O4 - DOX | Células Hela | – | Vantagens: Baixa toxicidade, alta biodistribuição, liberação lenta do fármaco e baixa degradação do fármaco | [156] |
| HA-Olb-PPMNPs | TNBC | – | Vantagens: Segmentação eficaz | [157] |
| CS-Fe 3 O 4 enxertado com IR820 | Melanoma de pele celular | – | Vantagens: Citotoxicidade insignificante e alta estabilidade | [158] |
*FA (ácido fólico).
Declaração de contribuição de autoria do CRediT
Dr. Baghban: Funções/Redação - rascunho original; Análise formal; Investigação. Dr. Afarid : Redação - revisão e edição, Investigação. Dr. Soleymani: Administração de projetos; Supervisão; Conceitualização; Investigação; Funções/Redação - rascunho original; Redação - revisão e edição. Dra. Rahimi: Administração de projetos; Supervisão; Conceitualização; Investigação; Funções/Redação - rascunho original; Redação - revisão e edição.
Declaração de conflito de interesses
Os autores declaram não ter interesses financeiros concorrentes ou relacionamentos pessoais conhecidos que possam ter influenciado o trabalho relatado neste artigo.
Agradecimentos
RB e MA gostariam de agradecer o apoio de Universidade de Ciências Médicas de Shiraz (Shiraz, Irã) e JS gostaria de agradecer o apoio de Universidade de Ciências Médicas de Tabriz (Tabriz, Irã) . MR reconhece o apoio financeiro de Centro Nacional de Ciências, Polônia , via Grant UMO-2018/29/B/ST5/02412 .
Referências
-
[1]
Progresso recente em sistemas de administração de medicamentos baseados em nanopartículas para terapia do câncerBiologia do Câncer Med., 14 (3) (2017), págs. 228-241
-
[2]
Novos insights sobre o design de nanopartículas híbridas para câncer de pulmão: diagnóstico e tratamentoJ. Controle. Liberação, 295 (2019), págs. 250-267
-
[3]
Nanopartículas magnéticas na terapia e diagnóstico do câncerAdv. Saúde Mater., 9 (9) (2020), pág. 1901058
-
[4]
Nanopartículas multifuncionais para imagem e terapia de tumores cerebraisRev. Adv. de Entrega de Medicamentos, 66 (2014), págs. 42-57
-
[5]
Terapia do câncer: nanoteranóstica do câncer: melhorando a imagem e a terapia por meio de entrega direcionada através de barreiras biológicas (adv. Mater. 36/2011)Adv. Mater., 23 (36) (2011), págs. H209-H309-47
-
[6]
Desenvolvimento e caracterização de um novo nanocompósito condutor de polianilina-g-poliestireno/Fe3O4 para o tratamento do câncerCélulas Artif. Nanomed. Biotecnologia, 47 (1) (2019), págs. 873-881
-
[7]
Nanopartículas de magnetita para diagnóstico, tratamento e monitoramento do tratamento do câncer: avanços recentesMater. Hoje, 19 (3) (2016), págs. 157-168
-
[8]
Síntese mediada por PEG de nanopartículas superparamagnéticas multifuncionais altamente dispersivas: suas propriedades físico-químicas e função in vivoACS Nano, 4 (4) (2010), págs. 2402-2410
-
[9]
Nanopartículas magnéticas de óxido de ferro suportadas em KCC-1 funcionalizado com amino propil como catalisador reciclável robusto para síntese one pot e verde de tetra-hidrodipirazolopiridinas e avaliação de citotoxicidadeAplicação Organomet. Química, 34 (3) (2020)
-
[10]
Preparação, funcionalização de superfície e aplicação de nanopartículas magnéticas de Fe3O4Ciência da Interface Coloidal Avançada, 281 (2020), Artigo 102165
-
[11]
Exossomos sanguíneos dotados de propriedades magnéticas e de direcionamento para terapia do câncerACS Nano, 10 (3) (2016), págs. 3323-3333
-
[12]
Os exossomos derivados de tumores são uma fonte de antígenos de rejeição tumoral compartilhados para o cross-priming de CTLMedicina Natural, 7 (3) (2001), págs. 297-303
-
[13]
Exossomos liberados por tumores e suas implicações na imunidade ao câncerMorte celular diferente. 15 (1) (2008), págs. 80-88
-
[14]
Microvesículas liberadas de células-tronco de câncer renal humano estimulam angiogênese e formação de nicho pré-metastático pulmonarPesquisa sobre Câncer, 71 (15) (2011), págs. 5346-5356
-
[15]
Co-entrega de doxorrubicina e metotrexato por quitosana dendrítica-g-mPEG como um nanocarreador magnético para entrega de múltiplos fármacos em quimioterapia combinadaPolím. Química, 8 (47) (2017), págs. 7333-7350
-
[16]
Nanoflores híbridas de enzimas inorgânicas incorporadas em nanopartículas magnéticas com atividade semelhante à peroxidase e canalização de substrato aprimoradas para biossensores de glicoseAdv. Saúde Mater., 8 (9) (2019), pág. 1801507
-
[17]
A hipertermia de nanopartículas magnéticas controladas por temperatura inibe o crescimento do tumor primário e a disseminação de metástasesNanomed.: Nanotecnologia Biol. Med., 25 (2020), Artigo 102171
-
[18]
Nanopartículas magnéticas como agentes de contraste para ressonância magnéticaSurf. -Modif. Nanobiomater. Eletroquímica. Biomédica. Apl. (2020), págs. 49-91
-
[19]
Imagem tomográfica de partículas magnéticas de nanopartículas direcionadas ao câncerNanoescala, 9 (47) (2017), págs. 18723-18730
-
[20]
Tendências atuais em modificações químicas de nanopartículas magnéticas para administração direcionada de medicamentos na quimioterapia do câncerRev. Metab. de Medicamentos, 52 (1) (2020), págs. 205-224
-
[21]
Modificação de superfície de nanopartículas magnéticas de óxido de ferroNanomateriais, 8 (10) (2018), pág. 810
-
[22]
M. Angelakeris, Nanopartículas magnéticas: um veículo multifuncional para teranóstica moderna, Biochim. Biophys. Acta (BBA)-Gen. Subj. 1861(6) (2017) 1642–1651.
-
[23]
Desenvolvimento de nanopartículas superparamagnéticas revestidas com ácido poliacrílico e hidróxido de alumínio como um agente de contraste eficiente para imagens multimodaisNanomateriais, 9 (11) (2019), pág. 1626
-
[24]
Hipertermia de nanopartículas magnéticas direcionadas para o tratamento do câncer oralJ. Patologia Oral Med., 48 (9) (2019), págs. 803-809
-
[25]
Efeitos da hipertermia local e corporal total na imunidadeHyperth. Tratamento de câncer: Um Prim. (2006), págs. 247-275
-
[26]
Hipertermia versus oncotermia: efeitos celulares na terapia complementar do câncerEvid. - Complemento Baseado. Alter. Med., 2013 (2013)) (2013), págs. 1-12
-
[27]
Hipertermia de nanopartículas magnéticas, Tecnologias eletromagnéticas emergentes para doenças cerebraisDiagn., Monit. Ther., Mola (2018), págs. 129-191
-
[28]
Capítulo 16 - Hipertermia do câncer mediada por nanopartículas magnéticasE. Paulo, E. Bhatia (Eds.), Assistência médica inteligente para diagnóstico e prevenção de doenças, Imprensa Acadêmica (2020), págs. 153-173
-
[29]
Nanopartículas magnéticas para hipertermia no tratamento do câncer: uma ferramenta emergenteCiências Ambientais, Pesquisa Poluição, 27 (16) (2020), págs. 19214-19225
-
[30]
Estudo multi-institucional de sarcomatose peritoneal de sarcoma uterino tratado com cirurgia citorredutora e quimioterapia intraperitoneal hipertérmicaEur. J. Surg. Oncol., 43 (11) (2017), págs. 2170-2177
-
[31]
Hipertermia magnética administrada sistemicamente para tratamento de câncer de próstataFarmacêutica, 12 (11) (2020), pág. 1020
-
[32]
Tratamento de camundongos BALB/c portadores de câncer de mama com hipertermia magnética usando nanopartículas de óxido de ferro funcionalizadas com dendrímerosNanomateriais, 10 (11) (2020), pág. 2310
-
[33]
Nanopartículas de óxido de ferro teranósticas de direcionamento ativo para ablação de câncer de pulmão por ultrassom focalizado guiada por ressonância magnética e ressonância magnéticaBiomateriais, 127 (2017), págs. 25-35
-
[34]
Deposição de imunoglobulina na coroa de biomoléculas determina a eficiência de opsonização do complemento de nanopartículas pré-clínicas e clínicasNat. Nanotecnologia, 14 (3) (2019), págs. 260-268
-
[35]
Implicação das nanopartículas magnéticas na detecção, rastreio e tratamento do cancroMagnetoquímica, 5 (4) (2019), pág. 55
-
[36]
Nanopartículas: propriedades, aplicações e toxicidadesÁrabe. J. Chem., 12 (7) (2019), págs. 908-931
-
[37]
Nanopartículas de óxido de ferro superparamagnéticas — aplicações médicas atuais e prospectivasMateriais, 12 (4) (2019), pág. 617
-
[38]
Contraste in vivo de alta sensibilidade para ressonância magnética de campo ultrabaixo usando nanopartículas de óxido de ferro superparamagnéticasCiência Avançada, 6 (29) (2020), pág. eabb0998
-
[39]
Estudos abrangentes de citotoxicidade de nanopartículas de óxido de ferro superparamagnéticasBioquímica. Biofísica. Rep., 13 (2018), págs. 63-72
-
[40]
Óxidos de ferro superparamagnéticos como traçadores de MPI: uma introdução e revisão de aplicações iniciaisRev. Adv. de Entrega de Medicamentos, 138 (2019), págs. 293-301
-
[41]
Aquecimento por indução baseado em nanopartículas em baixas magnitudes de intensidades de campo magnético para terapia de câncer de mamaJ. Magn. Magn. Mater., 483 (2019), págs. 169-177
-
[42]
Nanopartículas de óxido de ferro para administração de medicamentos guiada magneticamente e com resposta magnéticaInt. J. Mol. Ciência, 16 (4) (2015), págs. 8070-8101
-
[43]
Nanopartículas de óxido de ferro superparamagnéticas para diagnóstico e terapia do câncerJ. Biomed. Nanotecnologia, 15 (2) (2019), págs. 215-416
-
[44]
Preparação e caracterização de nanopartículas superparamagnéticas de óxido de ferro para administração de fármacos guiada magneticamenteInt. J. Nanomed., 13 (2018), págs. 43-46
-
[45]
Nanopartículas magnéticas poliméricas multifuncionais baseadas em ferrofluidos para tratamento multimodal in vitro do câncer usando termoterapia e quimioterapiaJ. Molecular. Líquido, 293 (2019), Artigo 111549
-
[46]
Nanopartículas de PLGA encapsuladas em SPION altamente versáteis como ablatores fototérmicos de células cancerígenas e como agentes de imagem multimodalCiências Biológicas, 5 (3) (2017), págs. 432-443
-
[47]
Estudo in vitro de nanopartículas multifuncionais PLGA-SPION carregadas com gemcitabina como radiossensibilizador usado em radioterapiaIrã. J. Pharm. Res.: IJPR, 18 (4) (2019), págs. 1694-1703
-
[48]
Terapia de hipertermia magnética para o tratamento de glioblastoma: uma revisão da história, eficácia e aplicação da terapia em humanosInt. J. Hipertensão, 34 (8) (2018), págs. 1316-1328
-
[49]
Nanopartículas de óxido de ferro superparamagnéticas revestidas com policaprolactona para terapia de hipertermia magnética in vitro do câncerEur. Polím. J., 133 (2020), Artigo 109789
-
[50]
Hipertermia in vitro com estabilidade coloidal melhorada e SAR aprimorado de nanoestruturas de núcleo/casca magnéticaMater. Ciências Eng.: C., 59 (2016), págs. 702-709
-
[51]
Síntese hidrotérmica de nanopartículas de Fe3O4 envolvendo HEPES e sua aplicação biológicaAdvogado RSC, 5 (7) (2015), págs. 5059-5067
-
[52]
Conjugação de anticorpos de nanopartículas como terapêutica para tratamento do câncer de mamaInt. J. Mol. Ciência, 21 (17) (2020), pág. 6018
-
[53]
Nanopartícula de porfirina-óxido de ferro superparamagnético conjugada com trastuzumabe: um potencial agente bimodal PTT-MRI para câncer de mama positivo para herceptinaFoto Fotodinâmica. Ther., 31 (2020), Artigo 101896
-
[54]
Encapsulamento de nanopartículas de óxido de ferro superparamagnéticas com biopolímero de poliaspartamida para terapia de hipertermiaEur. Polím. J., 122 (2020), Artigo 109396
-
[55]
Um sistema de administração direcionado às superfícies de formação óssea para facilitar a terapia anabólica baseada em RNAiMedicina Natural, 18 (2) (2012), págs. 307-314
-
[56]
A inibição da furina por nanopartículas superparamagnéticas de óxido de ferro direcionadas ao osso aliviou a metástase óssea do câncer de mamaMatéria-prima Bioact., 6 (3) (2021), págs. 712-720
-
[57]
Nanopartículas de sílica mesoporosa multifuncionais com gatekeeper termo-responsivo para quimio/fototerapia acionada por luz NIRPequeno, 12 (31) (2016), págs. 4286-4298
-
[58]
Sistemas de administração de gemcitabina assistidos por reação enzimática dupla para terapia programada de câncer pancreáticoACS Nano, 11 (2) (2017), págs. 1281-1291
-
[59]
Nanoestruturas peptídicas automontadas, termoestáveis, estabilizadas em hélice e resistentes à protease como potenciais inibidores de interações proteína-proteínaBiomacromoléculas, 14 (8) (2013), págs. 2684-2689
-
[60]
Gerenciando a imunogenicidade indesejada de produtos biológicosAutoimune. Rev., 14 (7) (2015), págs. 569-574
-
[61]
Conjugados peptídeo-nanopartículas: uma próxima geração de plataformas diagnósticas e terapêuticas?Nano Convergência, 5 (1) (2018), págs. 1-18
-
[62]
Síntese de nano-sílica fibrosa dendrítica dopada com térbio funcionalizada com ácido fólico e interação com células HEK 293 normais, células de câncer de mama MDA e células de câncer de cólon HT 29J. Mol. Reconhecer., 33 (11) (2020), pág. 2871
-
[63]
Citosensorização altamente sensível e específica de células de câncer colorretal HT 29 usando nanopartículas KCC-1 funcionalizadas com ácido fólicoBiosens. Bioelétron., 132 (2019), págs. 122-131
-
[64]
Uma rota fácil para nanoesferas ocas de sílica mesoporosa com tamanho ajustávelQuímica Comunitária, 23 (2008), págs. 2629-2631
-
[65]
Nanoestruturas mesoporosas ocas/do tipo chocalho por uma estratégia de corrosão seletiva baseada em diferenças estruturaisACS Nano, 4 (1) (2010), págs. 529-539
-
[66]
Micro‐/nanoestruturas ocas: síntese e aplicaçõesAdv. Mater., 20 (21) (2008), págs. 3987-4019
-
[67]
Nanopartículas magnéticas de óxido de ferro-esferas de sílica mesoporosa oca: fabricação e potencial aplicação na administração de medicamentosAtual. Aplicação Física, 20 (2) (2020), págs. 320-325
-
[68]
Preparação e caracterização de nanopartículas de sílica mesoporosa multifuncionais para ressonância magnética dupla e imagem de fluorescência em terapia direcionada ao câncerMatéria mesoporosa microporosa. 250 (2017), págs. 210-220
-
[69]
Liberação controlada intracelular induzida por células de cisteína impermeável à membrana a partir de um sistema de administração de fármacos baseado em nanopartículas de sílica mesoporosaQuímica Comunitária, 22 (2009), págs. 3219-3221
-
[70]
RW Rand, HD Snow, DG Elliott, GM Haskins, Método de aquecimento por indução para uso em causar necrose de neoplasia, Google Patents, 1985.
-
[71]
Imunoterapia contra o câncer baseada em hipertermia intracelular usando nanopartículas de magnetita: um novo conceito de “necrose controlada pelo calor” com expressão de proteína de choque térmicoCâncer Imunol. Imunooutro., 55 (3) (2006), págs. 320-328
-
[72]
Nanomateriais magnéticos para terapia baseada em hipertermia e administração controlada de medicamentosRev. Adv. de Entrega de Medicamentos, 63 (9) (2011), págs. 789-808
-
[73]
Uma nanoplataforma biodegradável MnSiO3@ Fe3O4 para terapia combinatória de câncer guiada por ressonância magnética de modo duploBiomateriais, 194 (2019), págs. 151-160
-
[74]
Nanopartículas magnéticas modificadas por andaimes porosos para regeneração óssea e terapia fototérmica contra tumoresNanomed.: Nanotecnologia Biol. Med., 14 (3) (2018), págs. 811-822
-
[75]
Preparação de nanopartículas magnéticas de núcleo duplo-casca de ácido tânico Fe3O4@ SiO2@ por meio da estratégia de reação multicomponente Ugi como co-entrega responsiva ao pH de doxorrubicina e metotrexatoMatéria. Química. Física, 247 (2020), Artigo 122857
-
[76]
Nanopartículas de sílica magnetoluminescentes direcionáveis a tumores para luminescência bimodal controlada por tempo/ressonância magnética de células cancerígenas in vitro e in vivoTalanta, 220 (2020), Artigo 121378
-
[77]
Fotossensibilizador nano-Fe3O4 magnético revestido com SiO2 para terapia quimio-fototérmica sinérgica direcionada a tumoresSurf de colóides. B: Biointerfaces, 195 (2020), Artigo 111274
-
[78]
Liberação de medicamentos fotoativáveis a partir de nanopartículas plasmônicas para terapia direcionada ao câncerACS Nano, 5 (10) (2011), págs. 7796-7804
-
[79]
Estudos experimentais e teóricos de conversão de luz em calor e efeitos de aquecimento coletivo em soluções de nanopartículas metálicasNano Lett., 9 (3) (2009), págs. 1139-1146
-
[80]
Uma síntese fácil de uma única etapa de nanopartículas magneto-plasmônicas multinúcleo ternáriasNanoescala, 6 (7) (2014), págs. 3532-3535
-
[81]
Progresso recente em sínteses e aplicações de nanopartículas do tipo haltereAdv. Mater., 21 (30) (2009), págs. 3045-3052
-
[82]
Nanopartículas de Au−Fe3O4 semelhantes a halteres para administração de platina em alvos específicosJ. Am. Química Soc., 131 (12) (2009), págs. 4216-4217
-
[84]
Entrega de aptâmeros fotocontrolados por nanopartículas magnéticas de ouro de superfície dupla para terapia direcionada ao câncerMater. Ciências Eng.: C., 80 (2017), págs. 88-92
-
[85]
Nanorods de ouro modificados por dendrímeros conjugados com RGD para direcionamento de tumores in vivo e terapia fototérmicaFarmácia Mol., 7 (1) (2010), págs. 94-104
-
[86]
Teranóstica: combinando imagem e terapiaQuímica Bioconjugada, 22 (10) (2011), págs. 1879-1903
-
[87]
Nanopartículas multifuncionais para imagem multimodal e teragnosiaSociedade Química Rev., 41 (7) (2012), págs. 2656-2672
-
[88]
Um sistema de administração de hidrogel de quitosana para terapia genética de osteossarcoma com fator derivado do epitélio pigmentar combinado com quimioterapiaBiomateriais, 30 (27) (2009), págs. 4815-4823
-
[89]
Aumento da toxicidade de quimioterápicos contra o câncer com hipertermia de nanorod de ouroAdv. Mater., 20 (20) (2008), págs. 3832-3838
-
[90]
Nanopartículas de sílica mesoporosa magnética revestidas com pontos quânticos de grafeno como uma plataforma multifuncional para administração controlada de medicamentos, hipertermia magnética e terapia fototérmicaPequeno, 13 (2) (2017), pág. 1602225
-
[91]
A coadministração de iRGD com nanopartículas responsivas a múltiplos estágios melhorou a capacidade de segmentação e penetração do tumor para terapia do câncer de mamaInterfaces de aplicação ACS Mater. 10 (26) (2018), págs. 22571-22579
-
[92]
Nanopartículas de redução de tamanho acionadas por enzimas e liberação de NO aprimorada por laser para penetração profunda em tumores e terapia combinadaBiomateriais, 168 (2018), págs. 64-75
-
[93]
Os nanohíbridos magneto-plasmônicos podem combinar eficientemente fototermia com hipertermia magnética?Nanoescala, 7 (45) (2015), págs. 18872-18877
-
[94]
Administração de fármacos fototermicamente melhorada por nanocristais multifuncionais ultrapequenos de FeCo/casca de grafiteACS Nano, 5 (2) (2011), págs. 1505-1512
-
[95]
Efeito sinérgico da terapia quimio-fototérmica usando óxido de grafeno PEGiladoBiomateriais, 32 (33) (2011), págs. 8555-8561
-
[96]
Nanopartículas magnéticas de ouro multifuncionais para administração combinada eficiente de medicamentos direcionados e terapia fototérmica intersticialInternacional J. Pharm., 554 (2019), págs. 256-263
-
[97]
Células vermelhas teranósticas multifuncionais para terapia combinada in vivo de câncer com campo magnético aprimoradoAdv. Mater., 26 (28) (2014), págs. 4794-4802
-
[98]
Aplicações terapêuticas de CRISPR/Cas9 no câncer de mama e potencial de entrega de nanomateriais de ouroNanobiomedicina, 7 (1849543520983196) (2020)
-
[99]
Nanoheteroestrutura de ouro magnético direcionada à mitocôndria para terapia fototérmica e fotodinâmica guiada por imagem multimodal de câncer de mama triplo-negativoEngenharia Química J., 403 (2021), Artigo 126364
-
[100]
Nanopartículas baseadas em polissacarídeos para nanomedicina teranósticaRev. Adv. de Entrega de Medicamentos, 99 (2016), págs. 70-84
-
[101]
Captação seletiva de micelas poliméricas de quitosana por monócitos circulantes para melhor direcionamento de tumoresCarboidrato. Polímero, 229 (2020), Artigo 115435
-
[102]
Sistema de administração de nanofármacos lipídicos modificados com quitosana para o tratamento direcionado e responsivo da colite ulcerativaCarboidrato. Polímero, 230 (2020), Artigo 115613
-
[103]
Fabricação e estudo de nanopartículas carregadas de curcumina baseadas em folato-quitosana para aplicação na terapia do câncer de mamaCarboidrato. Polímero, 168 (2017), págs. 14-21
-
[104]
Inibição do estroma promotor de tumor para reforçar o direcionamento subsequente de AT1R em células tumorais por micelas inspiradas em patologiaBiomateriais, 161 (2018), págs. 33-46
-
[105]
Nanopartículas modificadas por polissacarídeos com capacidade de direcionamento inteligente do receptor CD44 para entrega de genesInt. J. Nanomed., 13 (2018), págs. 3989-4002
-
[106]
Conjugados de polissacarídeo reticulado com boronato para administração de fármacos direcionada e responsiva ao pHQuímica Comunitária, 55 (8) (2019), págs. 1164-1167
-
[107]
Nanopartículas híbridas de núcleo-casca magnético para terapia anticâncer direcionada a receptores e ressonância magnéticaJ. Ciência da Interface Coloidal, 486 (2017), págs. 112-120
-
[108]
Projeto de sistemas de administração de fármacos contendo artemisinina e seus derivadosMoléculas, 22 (2) (2017), pág. 323
-
[109]
Nanopartículas magnéticas de quitosana carregadas com artemisinina para direcionamento eficiente ao câncer de mamaInt. J. Biol. Macromol., 104 (2017), págs. 1853-1859
-
[110]
Uma abordagem simples para projetar nanopartículas de Fe3O4 funcionalizadas com quitosana para administração de doxorrubicina em pH responsivo para terapia do câncerJ. Magn. Magn. Mater., 448 (2018), págs. 199-207
-
[111]
Um novo nanocompósito magnético de núcleo-casca biocompatível baseado em hidrogéis de quitosana reticulados para hipertermia in vitro de terapia de câncerInt. J. Biol. Macromol., 140 (2019), págs. 407-414
-
[112]
Nanopartículas glicolipídicas derivadas de quitosana para terapia fotodinâmica guiada por ressonância magnética do câncerCarboidrato. Polímero, 245 (2020), Artigo 116509
-
[113]
Nanopartículas como sistemas de administração de fármacos na medicina do câncer: ênfase em nanolipossomas contendo RNAiProdutos farmacêuticos, 6 (11) (2013), págs. 1361-1380
-
[114]
Complexos metálicos na terapia do câncer – uma atualização da perspectiva do design de medicamentosDes. de Drogas. Dev. Ther., 11 (2017), págs. 599-616
-
[115]
Nanopartículas inorgânicas na terapia do câncerPesquisa Farmacêutica, 28 (2) (2011), págs. 237-259
-
[116]
Propriedades e aplicações de nanopartículas de metais nobres coloidais não esféricasAdv. Mater., 22 (16) (2010), págs. 1805-1825
-
[117]
Aplicações biológicas de nanopartículas de ouroSociedade Química Rev., 37 (9) (2008), págs. 1896-1908
-
[118]
Modificação de superfície, funcionalização e bioconjugação de nanopartículas inorgânicas coloidaisFilósofo. Trans. R. Soc. A: Matemática. Física. Eng. Ciências, 368 (1915) (2010), págs. 1333-1383
-
[119]
Nanopartículas de ouro em aplicações de entregaRev. Adv. de Entrega de Medicamentos, 60 (11) (2008), págs. 1307-1315
-
[120]
Nanocarreadores se preparam para uma vida longaNat. Nanotecnologia, 2 (4) (2007), págs. 203-204
-
[121]
Compreendendo a eficiência de conversão fototérmica de nanocristais de ouroPequeno, 6 (20) (2010), págs. 2272-2280
-
[122]
Nanopartículas para terapia térmica do câncerJ. Engenharia Biomecânica, 131 (7) (2009), Artigo 074001
-
[123]
Arranjo ordenado de nanorods de GdPO4 hidratados em matriz de quitosana magnética promove terapia fototérmica tumoral e regeneração óssea contra metástases ósseas de câncer de mamaEngenharia Química J., 381 (2020), Artigo 122694
-
[124]
Nanopartículas de granada de gadolínio e alumínio dopadas com cério e magnetoluminescentes para geração simultânea de imagens e terapia fotodinâmica de células cancerígenasJ. Ciência da Interface Coloidal, 526 (2018), págs. 220-229
-
[125]
Nanopartículas magnéticas funcionalizadas carregadas com dissulfiram combinadas com nitroprussiato de cobre e sódio em células de câncer de mamaMater. Ciências Eng.: C., 119 (2021), Artigo 111452
-
[126]
Síntese fácil de nanopartículas biocompatíveis baseadas em Fe3O4 para erradicação de tumores guiada por ressonância magnética de modelo duplo responsiva ao pH por terapia fototérmicaQueixo. J. Anal. Química, 47 (5) (2019), págs. 678-685
-
[127]
Nanomateriais à base de carbono: materiais multifuncionais para engenharia biomédicaACS Nano, 7 (4) (2013), págs. 2891-2897
-
[128]
Nanomateriais à base de carbono como uma plataforma emergente para teranósticaMater. Horiz., 6 (3) (2019), págs. 434-469
-
[129]
Nanomateriais não metálicos em teranóstica do câncer: uma revisão de sistemas de administração de fármacos à base de sílica e carbonoCiência, Tecnologia, Avan. Mater., 14 (4) (2013), Artigo 044407
-
[130]
Direcionamento do câncer e administração de medicamentos usando pontos quânticos e nanotubos baseados em carbonoMoléculas, 23 (2) (2018), pág. 378
-
[131]
Terapia de câncer guiada por imagem usando nanopartículas de carbono Fe3O4@ reticuladas e responsivas a magnetismo funcionalizadas por aptâmerosAnal. Química. Acta, 1056 (2019), págs. 108-116
-
[132]
Vries, Superando a barreira hematoencefálica do tumor para um tratamento eficaz do glioblastomaResistência a Medicamentos. Atualizações, 19 (2015), págs. 1-12
-
[133]
Nanopartículas Ag@ Fe3O4@ C para direcionamento sinérgico quimio-fototérmico guiado por imagem multimodal para terapia do câncerAnal. Química. Acta, 1086 (2019), págs. 122-132
-
[134]
Os polietilenoglicóis anfipáticos prolongam efetivamente o tempo de circulação dos lipossomasFEBS Lett., 268 (1) (1990), págs. 235-237
-
[135]
Estudo de fase I e farmacocinético do Genexol-PM, um paclitaxel formulado em micelas poliméricas, livre de cremóforo, em pacientes com malignidades avançadasPesquisa Clínica do Câncer, 10 (11) (2004), págs. 3708-3716
-
[136]
Visando o microambiente tumoral com nanopartículas anfifílicas baseadas em PEG para superar a quimiorresistênciaNanomed.: Nanotecnologia, Biol. Med., 12 (2) (2016), págs. 269-286
-
[137]
Nanopartículas magnéticas reticuladas com uma ligação amida biocompatível para imagens de ressonância óptica/magnética dupla direcionadas ao câncerSurf de colóides. B: Biointerfaces, 161 (2018), págs. 183-191
-
[138]
Tendências atuais em terapia direcionada para infecções resistentes a medicamentosAplicação Microbiol. Biotecnologia, 103 (20) (2019), págs. 8301-8314
-
[139]
Engenharia de anticorpos promove nanomedicina para tratamento de câncerNanomedicina, 5 (8) (2010), págs. 1141-1145
-
[140]
Promoção da administração de nanopartículas a duas populações de células-tronco do câncer gástrico por anticorpos CD133 e CD44Biomédica. Farmacêutica., 115 (2019), Artigo 108857
-
[141]
Microcápsulas superparamagnéticas de PLGA-óxido de ferro para imagens de US/RM de modalidade dupla e ablação de câncer de mama por US de alta intensidade focadaBiomateriais, 33 (24) (2012), págs. 5854-5864
-
[142]
Avaliação de microcápsulas superparamagnéticas de compósito de óxido de ferro-polímero para cirurgia de câncer por ultrassom focalizado de alta intensidade guiada por ressonância magnéticaBMC Câncer, 14 (1) (2014), págs. 1-11
-
[143]
Síntese de nanopartículas de óxido de ferro conjugadas com ligantes anti-EGFR teranósticos para ressonância magnética para tratamento de câncer de fígadoJ. Drug Deliv. Ciência e Tecnologia, 55 (2020), Artigo 101367
-
[144]
Administração in vivo de docetaxel encapsulado em nanoesfera de sílica para terapia de câncer de fígado com baixa toxicidade e alta eficáciaACS Nano, 4 (11) (2010), págs. 6874-6882
-
[145]
Nanomotor magnético semelhante a estomatócitos como transportador de fotossensibilizador para tratamento de câncer baseado em terapia fotodinâmicaSurf de colóides. B: Biointerfaces, 194 (2020), Artigo 111204
-
[146]
Nanopartículas magnéticas revestidas com polifenóis para fototermoterapia/imunoterapia de câncer controlada espaço-temporalmenteJ. Controle. Liberação, 326 (2020), págs. 131-139
-
[147]
Nanopartículas lipídicas sólidas para administração parenteral de medicamentosRev. Adv. de Entrega de Medicamentos, 56 (9) (2004), págs. 1257-1272
-
[148]
Conjugados de polímeros como nanomedicamentos anticancerígenosRev. Nacional Câncer, 6 (9) (2006), págs. 688-701
-
[149]
Nanomedicamentos poliméricos para administração de medicamentos guiada por imagem e terapia combinada direcionada a tumoresNano Hoje, 5 (3) (2010), págs. 197-212
-
[150]
Polímeros na administração de medicamentos — estado da arte e tendências futurasAdv. Eng. Mater., 13 (3) (2011), págs. B61-B87
-
[151]
Nanopartículas de núcleo corona 'Stealth' modificadas com superfície de polietilenoglicol (PEG): influências da corona (comprimento da cadeia de PEG e densidade de superfície) e da composição do núcleo na captação fagocitária e adsorção de proteínas plasmáticasSurf de colóides. B: Biointerfaces, 18 (3–4) (2000), págs. 301-313
-
[152]
Nanopartículas de polímero biocompatíveis para aplicações de administração de fármacos em terapias contra o câncer e doenças neurodegenerativasJ. Função Biomatéria., 10 (1) (2019), pág. 4
-
[153]
Nanopartículas magnéticas baseadas em PLA armadas com polímeros termo/pH responsivos para quimioterapia combinada contra o câncerJ. Drug Deliv. Ciência e Tecnologia, 45 (2018), págs. 240-254
-
[154]
Anidrase carbônica IX como alvo de terapia anticâncer: avaliação pré-clínica de anticorpo monoclonal internalizante direcionado ao domínio catalíticoFarmácia atual Des., 16 (29) (2010), págs. 3255-3263
-
[155]
Nanopartículas magnéticas projetadas com poli -L -lisina para hipertermia combinada, ressonância magnética e detecção de células cancerígenasJ. Magn. Magn. Mater., 475 (2019), págs. 316-326
-
[156]
Um hidrogel natural magnético bioinspirado contendo gelatina e alginato como um sistema de administração de medicamentos para quimioterapia do câncerInt. J. Biol. Macromol., 156 (2020), págs. 438-445
-
[157]
Um nanosistema magnético multifuncional baseado no efeito “two strikes” para terapia anticâncer sinérgica em câncer de mama triplo-negativoJ. Controle. Liberação, 322 (2020), págs. 401-415
-
[158]
Nanopartículas magnéticas de corante multifuncionais de infravermelho próximo para bioimagem e terapia do câncerCâncer Lett., 390 (2017), págs. 168-175
-
[159]
Aplicações de nanopartículas magnéticas bacterianas em nanobiotecnologiaJ. Nanosci. Nanotecnologia, 16 (3) (2016), págs. 2164-2171
-
[160]
Magnetossomo bacteriano e sua potencial aplicaçãoPesquisa de microbiologia, 203 (2017), págs. 19-28
-
[161]
Bactérias magnetotáticas como fontes potenciais de bioprodutosMar. Drogas, 13 (1) (2015), págs. 389-430
-
[162]
Aplicações de magnetossomos sintetizados por bactérias magnetotáticas na medicinaFrente. Bioeng. Biotecnologia, 2 (2014), pág. 5
-
[163]
Terapia fototémica de câncer com alvo magnético in vivo com nanopartículas magnéticas bacterianasSurf de colóides. B: Biointerfaces, 172 (2018), págs. 308-314
-
[164]
Efeito sinérgico de nanopartículas de ouro e plasma frio na terapia do câncer de glioblastomaJ. Física D: Física Aplicada, 47 (33) (2014), Artigo 335402
-
[165]
O plasma atmosférico frio (CAP) altera a expressão genética de moléculas-chave da maquinaria de cicatrização de feridas e melhora a cicatrização de feridas in vitro e in vivoPLoS Um, 8 (11) (2013), Artigo e79325
-
[166]
Esterilização de bactérias, leveduras e endósporos bacterianos por plasma frio sob pressão atmosférica usando hélio e oxigênioJ. Microbiologia, 44 (3) (2006), págs. 269-275
-
[167]
Mecanismo de coagulação sanguínea por plasma de descarga de barreira dielétrica de pressão atmosférica não térmicaIEEE Trans. Ciência do Plasma, 35 (5) (2007), págs. 1559-1566
-
[168]
Um novo método de clareamento dentário usando microjato de plasma frio acionado por corrente contínua em ar de pressão atmosféricaIEEE Trans. Ciência do Plasma, 38 (11) (2010), págs. 3143-3151
-
[169]
Demonstração in vitro de propriedades inibidoras do câncer a partir da interface plasma-líquido auto-organizada estratificadaRep. Científica, 7 (1) (2017), págs. 1-11
-
[170]
Avaliação da tecnologia de regeneração cutânea por plasma no rejuvenescimento facial completo de baixa energiaArq. Dermatol., 143 (2) (2007), págs. 168-174
-
[171]
O efeito do ajuste da composição do plasma frio na viabilidade das células do glioblastomaPLoS Um, 9 (5) (2014), Artigo e98652
-
[172]
Plasma atmosférico frio e nanopartículas magnéticas à base de óxido de ferro para terapia sinérgica do câncer de pulmãoRadicais Livres Biol. Med., 130 (2019), págs. 71-81
-
[173]
Terapia nanocatalítica sinérgica de câncer com hipertermia fotônica/magnética possibilitada por nanocatalisadores de ferro de valência zeroBiomateriais, 219 (2019), Artigo 119374