Introdução
Campos magnéticos de baixa frequência exercem efeitos não invasivos, não ionizantes e não térmicos em células e tecidos. Eles aumentam a resposta ao estresse oxidativo celular e regulam a via de sinalização apoptótica, alterando o Ca 2+ intracelular concentração para induzir apoptose 1 , 2 , 3 . São amplamente utilizados para tratar tumores e doenças neuropsiquiátricas e ósseas. Estudos in vivo neste campo mostraram que campos magnéticos de baixa frequência inibem a proliferação de células tumorais e prolongam sua sobrevivência 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 .
Na maioria dos relatórios sobre o uso de campos magnéticos como terapia combinada, campos magnéticos de frequência extremamente baixa aumentam a eficácia de medicamentos antitumorais 12 , 13 , 14 , 15 . Uma combinação de um campo magnético de frequência extremamente baixa com paclitaxel no tratamento de câncer de camundongo revelou que o campo magnético aumentou a letalidade de execução do paclitaxel 16 . A permeabilidade da membrana celular foi alterada, e o efeito terapêutico da cisplatina foi significativamente aumentado em um campo magnético de frequência extremamente baixa de 10 mT combinado com cisplatina 17 . No entanto, Gellrich descobriu que o campo magnético de baixa frequência não conseguiu aumentar o efeito terapêutico do cetuximabe, o que pode estar relacionado à mudança conformacional no receptor de superfície molecular 18 .
Na maioria dos experimentos in vitro, o campo magnético de baixa frequência mostrou um efeito inibitório significativo nas células tumorais 2 , 3 , 19 , 20 , 21 , 22 , 23 e não afetou o crescimento de células normais 2 , 24 . Um relatório descobriu que o campo magnético afetou a superfície da membrana tumoral, influenciando assim a proliferação tumoral 25 . No entanto, alguns relatórios mostraram que a proliferação de células tumorais aumentou ligeiramente sob o campo magnético de baixa frequência 26 .
Atualmente, acredita-se que os campos magnéticos podem inibir significativamente o crescimento do tumor, e o efeito inibitório tem uma correlação positiva com o tempo e a intensidade. Enquanto isso, a produção de espécies reativas de oxigênio (ROS) é um fenômeno inevitável considerado a chave para o efeito inibitório do campo magnético 3 . No entanto, o mecanismo exato não está claro. No desenvolvimento de terapias antineoplásicas, o efeito inibitório do campo magnético no crescimento do tumor é um atributo significativo para o desempenho clínico de muitas tecnologias existentes.
Muitos experimentos foram conduzidos sobre as diferenças nas configurações do campo magnético, mas pouca pesquisa foi feita sobre o efeito da diferença no campo magnético no ambiente do tumor e o possível mecanismo de inibição, exceto ROS. Neste estudo baseado no efeito de um campo magnético no ambiente intercelular e na estrutura intercelular (a forma de contato natural entre as células e a forma de interferência humana), as células foram cultivadas in vitro. O estudo descobriu que o estado de agregação intercelular era um fenômeno necessário para a inibição magnética. Ao mesmo tempo, durante a proliferação celular, um ou vários substratos relacionados foram liberados no meio condicionado, o que pode atuar junto com o campo magnético para atingir o efeito de inibição do campo magnético.
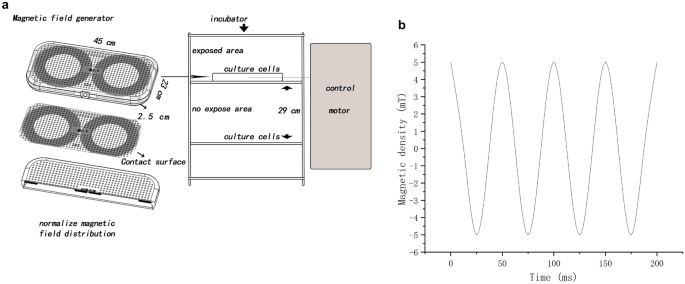
Neste experimento, um campo magnético de 5 mT e 20 Hz foi usado como único plano de fundo. Em experimentos anteriores, a intensidade do campo magnético não era fixa e, muitas vezes, não entrava em contato direto com as células ou não podia ser colocada em uma incubadora. O gerador de campo magnético simples projetado neste estudo poderia estar em contato direto com as células e colocado em uma incubadora sob condições estáveis de temperatura e CO 2 . Nosso gerador de campo magnético também tinha desvantagens, ou seja, quando um campo magnético era gerado, ele também gerava calor. Com base no projeto de intensidade de Crocetti 19 , um gerador de campo magnético foi projetado para estabilizar o calor por meio da dissipação de calor.
Resultados
O campo magnético inibiu as células tumorais aderentes, o que foi influenciado pela diferença no ambiente de cultura (meio condicionado)
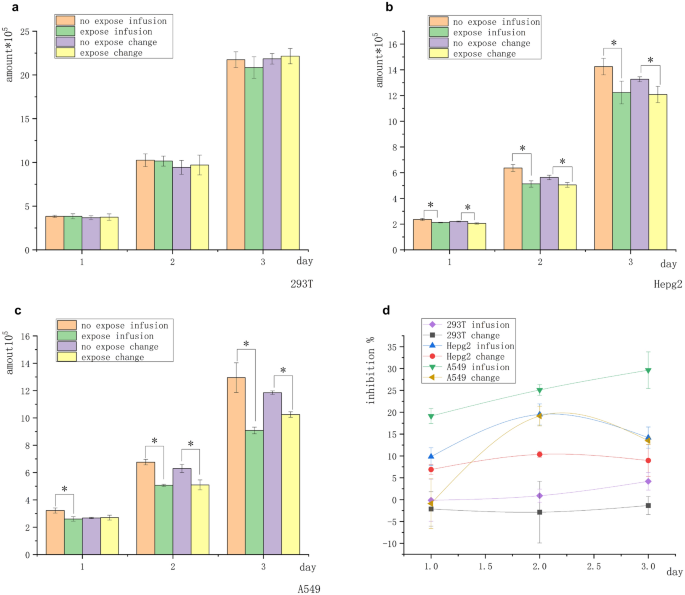
Os grupos de tratamento foram divididos em dois grupos antes da exposição. Grupo de infusão: Antes da exposição diária, 500 µL do meio fresco foram lentamente adicionados com uma pipeta à parede do poro. O meio de cultura condicionado era uma mistura de várias substâncias (meio incubado durante a noite após passagem e laminação) e um meio fresco para crescimento exponencial. Grupo de mudança: Antes da exposição diária, uma pipeta foi aplicada à parede do poro para remover a maior parte do meio (quase todo), que foi substituído por um meio do mesmo volume do grupo "infusão". O meio condicionado era completamente fresco, sem secreções ou com secreções mínimas. A diferença entre os dois grupos era a composição do meio condicionado: a composição no "grupo de infusão" era mais complexa, enquanto a composição no "grupo de mudança" era mais próxima daquela do meio não utilizado. Células epiteliais renais humanas normais 293 T, células de câncer de fígado humano Hepg2 e células de câncer de pulmão de células não pequenas humanas A549 foram processadas independentemente por meio de cultura “infusão” ou “mudança” e expostas à intensidade de 5 mT do campo magnético por 2 h a cada dia por um total de 3 dias. O número inicial de todas as células foi de 2 × 10 5 . A Figura 1 a mostra que a linhagem de células não tumorais 293 T não foi inibida pelo campo magnético no “grupo de infusão” e no “grupo de mudança”. As Figuras 1 b e c mostram que o número de células Hepg2 e A549 expostas ao campo magnético foi significativamente menor do que o de células no grupo de controle não exposto. Ambas as linhagens de células tumorais Hepg2 e A549 foram inibidas pelo campo magnético (a maior taxa de inibição de Hepg2 foi de cerca de 18%, e a de A549 foi de cerca de 30%). As células tumorais no “grupo de infusão” mostraram inibição no dia 1, enquanto as células no “grupo de mudança” não mostraram inibição significativa. A tendência de inibição no “grupo de infusão” foi significativamente mais forte do que no “grupo de mudança”. O efeito inibitório no “grupo de infusão” (A549) correlacionou-se positivamente com a duração da exposição (Fig. 1 d). Esses resultados indicaram que as células tumorais eram mais sensíveis ao campo magnético no meio condicionado (microambiente) modificado por sinais autócrinos e parácrinos.
Diferença no ambiente (meio condicionado) antes da exposição afetou o efeito inibitório do campo magnético nas células aderentes. ( a ) Nenhuma diferença significativa foi encontrada no número de células T 293 em 3 dias. ( b ) O número de células Hepg2 nos grupos não expostos e expostos foi significativamente diferente. ( c ) O número de células A549 nos grupos não expostos e expostos foi significativamente diferente. ( d ) Curva de inibição celular. A taxa de inibição celular no grupo de infusão foi mais óbvia do que no grupo de mudança, e a taxa de inibição celular normal não foi de significância estatística ( * P < 0,05, versus o grupo de controle sem exposição).
A agregação espontânea de células tumorais suspensas foi destruída e a inibição magnética desapareceu
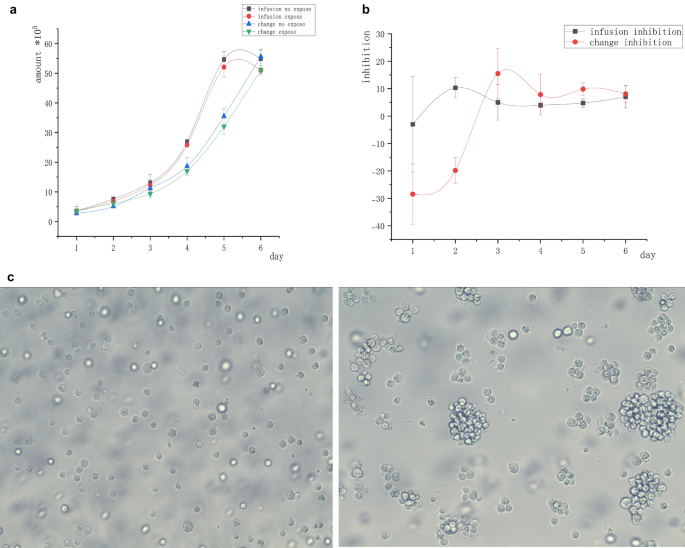
Investigamos se uma perda de nutrientes no meio condicionado, densidade celular excessiva e interferência com a inibição do campo magnético pela tripsina poderiam afetar a duração mais longa da inibição magnética. Em particular, realizamos o experimento usando células Raji de linfoma suspensas. Na cultura natural, as células suspensas se reuniram espontaneamente em grupos. A estrutura de tais grupos foi inevitavelmente destruída quando as células centrifugadas foram substituídas por um meio condicionado no grupo de mudança. Também destruímos a estrutura do grupo no grupo de infusão para garantir a consistência das condições experimentais. As células suspensas foram infundidas ou alteradas com o meio de cultura e expostas a um campo magnético de 5 mT por 2 h diariamente por 6 dias. Grupo de infusão: Antes da exposição diária, 500 µL do meio fresco foram lentamente adicionados com um pipetador à parede do poro, e as células foram sopradas com uma pistola de pipeta para separá-las em suspensão e destruir a estrutura aglomerativa. Mudança de grupo: Antes da exposição diária, a suspensão de células foi aspirada e centrifugada a 1200 rpm para remover o sobrenadante, que foi então substituído por um meio do mesmo volume do grupo “infusão”. No dia 3, o meio condicionado foi completamente substituído no grupo infusão, enquanto as células de ambos os grupos foram transferidas para recipientes maiores. As células tumorais suspensas foram cultivadas in vitro sem tripsina e facilmente transferidas para recipientes maiores, evitando danos à tripsina. Sob tais condições, nenhum dos grupos mostrou inibição significativa em comparação com o grupo controle sem exposição.
O número inicial de todas as células era 2 × 10 5 . A Figura 2 a não mostra nenhuma diferença significativa no número de células no “grupo de infusão” e no “grupo de mudança” após 6 dias de exposição ao campo magnético em comparação com o grupo de controle sem exposição. A Figura 2 b mostra que a inibição do campo magnético não era óbvia após o desaparecimento da estrutura de agregação.
Curva de crescimento celular de células tumorais Raji livremente suspensas nos grupos de infusão e troca. ( a ) Curvas de inibição celular sob diferentes graus de frescor do meio de cultura. Sob a condição de dispersão celular, nenhuma diferença significativa foi encontrada entre o número de células expostas ao campo magnético e aquelas no grupo controle não exposto. ( b) Curvas da taxa de inibição sob a condição de dispersão celular; as células tumorais não foram inibidas na exposição ao campo magnético sob diferentes graus de frescor do meio de cultura. ( c ) Agrupamento espontâneo de células (direita) e separação artificial (esquerda).
Conforme mostrado na Fig. 2 a, o número de células no “grupo de infusão” foi significativamente maior do que no “grupo de troca” no dia 4 (após a substituição do recipiente grande). O ambiente do “grupo de infusão” foi mais adequado para o crescimento de células tumorais suspensas.
A Figura 2c mostra células suspensas em estados suspensos separados e naturais. Foi visto que a maioria das células eram unicelulares em vez de aglomerados multicelulares após a destruição da estrutura do aglomerado.
A agregação espontânea de células tumorais suspensas foi mantida e a inibição magnética apareceu
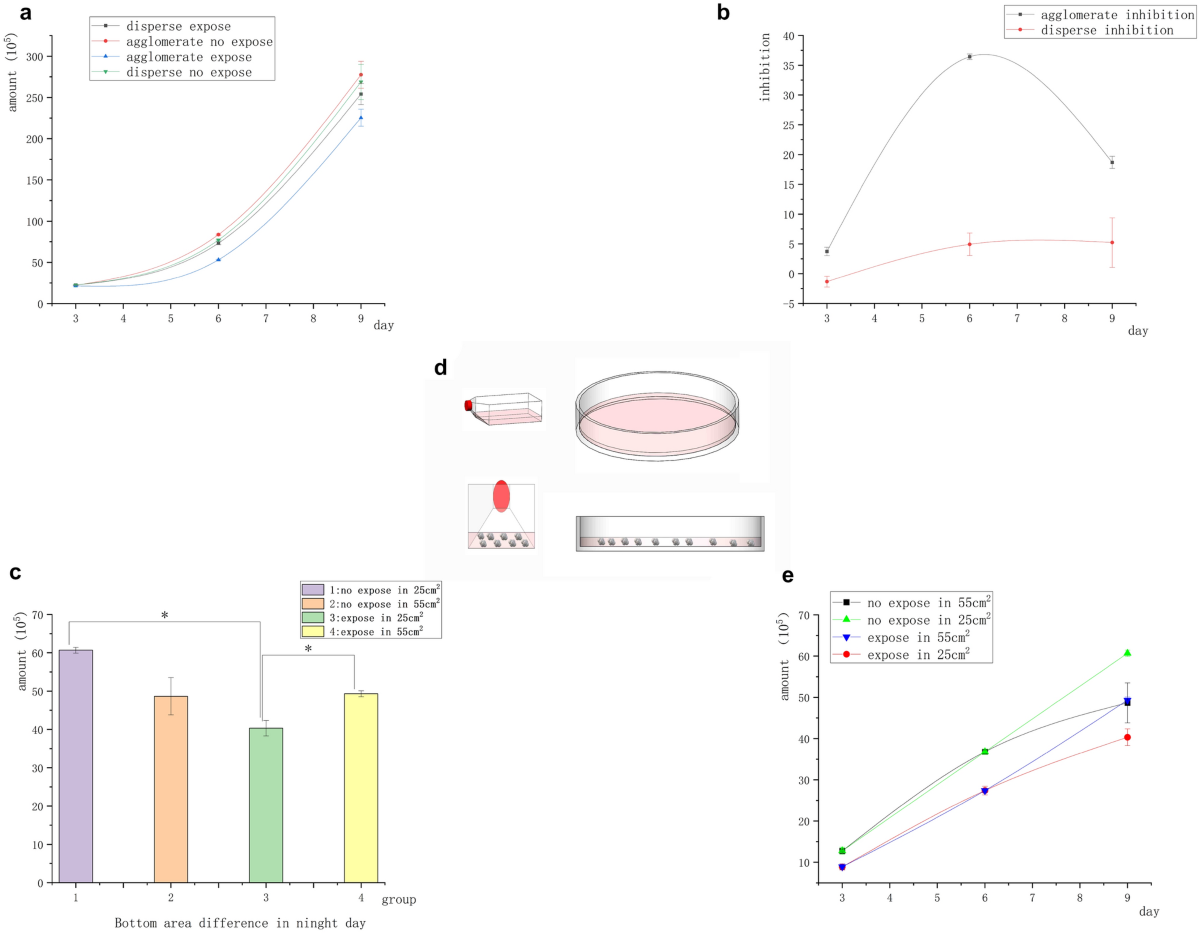
No experimento anterior em células de linfoma Raji, a agregação espontânea de células tumorais suspensas foi destruída e a inibição magnética desapareceu. Demonstramos que o campo magnético não exerceu nenhum efeito inibitório em células cancerígenas livremente suspensas. Neste grupo de experimentos, examinamos se o contato celular desempenhou um papel no efeito da inibição magnética no crescimento do tumor. Células Raji agregadas em grupos foram estudadas em um experimento de exposição contínua de 9 dias. As células foram transferidas para um recipiente maior, enquanto o meio de cultura foi trocado a cada 3 dias. Grupo “Aglomerado”: Nenhum procedimento foi realizado, exceto a substituição do meio a cada 3 dias e transferência para recipientes maiores. Grupo “Disperso”: Antes da exposição diária, as células foram sopradas com uma pistola de pipeta para separar as células em suspensão e destruir a estrutura aglomerativa.
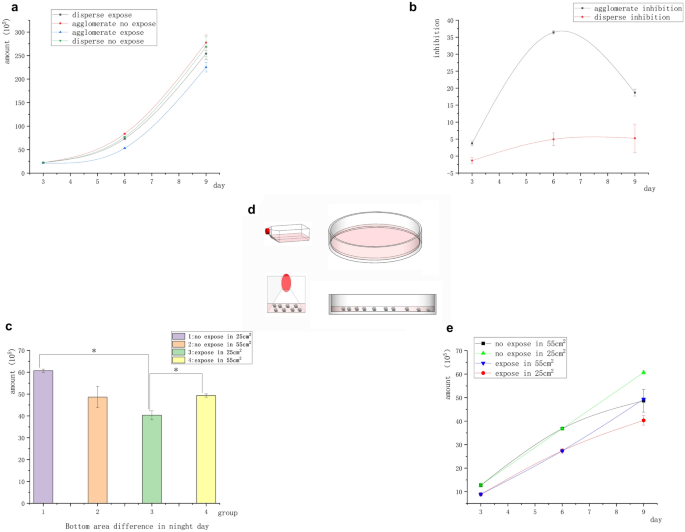
O número inicial de todas as células era 2 × 10 5 . A Figura 3 a mostra que o número de células Raji sob agregação de suspensão no campo magnético foi significativamente menor do que no grupo de controle não exposto, enquanto o número de células Raji sob separação de suspensão no campo magnético não mostrou diferenças significativas em comparação com o controle não exposto. A Figura 3 b mostra a diferença na taxa de inibição do campo magnético entre os dois grupos de células (agregação de suspensão e separação de suspensão). Ela indicou que as células Raji foram inibidas pelo campo magnético sob a condição de agregação de suspensão. Enquanto isso, as células Raji não foram inibidas pelo campo magnético sob a condição de separação de suspensão. As células Raji foram menos sensíveis à inibição magnética do que as células aderentes, e a taxa de inibição das células Raji no dia 6 foi semelhante à das células A549 no dia 3. Na ausência do campo magnético, o número de células Raji no grupo de agregação suspensa foi significativamente maior do que no grupo de separação suspensa. Em contraste, na exposição ao campo magnético, o número de células Raji no grupo de separação suspensa foi significativamente maior do que no grupo de agregação suspensa. No entanto, no dia 9, a inibição magnética diminuiu ou desapareceu. Repetimos o experimento para determinar as razões do desaparecimento da taxa de inibição no dia 9. Pegamos a área no fundo do recipiente como controle para investigar se as diferenças na densidade do aglomerado de células causaram a redução da inibição magnética (menos contato entre as células) e expusemos as células no estado agrupado a um campo magnético de 5 mT, 20 Hz por 9 dias. O meio condicionado foi trocado a cada 3 dias, e o recipiente grande foi substituído. A operação permaneceu inalterada pelos primeiros 6 dias. No sexto dia de transferência, as células foram divididas em recipientes com diferentes tamanhos de base [placa de Petri de 10 cm (55 cm 2 ) e placa de 25 cm 2 ]. frasco de cultura]. A única alteração foi que as células foram transferidas no dia 6, utilizando a placa de Petri de 10 cm (55 cm 2 ) e a placa de Petri de 25 cm 2 frasco (sob diferentes áreas basais, as massas celulares eram mais concentradas) como controles. Surpreendentemente, a taxa de inibição das células Raji no 25 cm 2 frasco foi tão alto quanto 36% no dia 9. A inibição das células Raji na placa de Petri de 10 cm (55 cm 2 ) desapareceu no dia 9 (Fig. 3 c). Os resultados foram consistentes com descobertas anteriores. A razão para esse resultado deve estar relacionada à proximidade das células (Fig. 3 d).
Inibição aglomerada e dispersa de células tumorais Raji suspensas. ( a ) A curva de crescimento de células suspensas com diferentes estruturas de contato mostrou que o número de células no grupo exposto ao campo magnético foi significativamente diferente daquele no grupo não exposto ao campo magnético sob a condição de agregação celular. No entanto, nenhuma diferença significativa foi encontrada entre o grupo exposto ao campo magnético e o grupo não exposto ao campo magnético sob a condição de dispersão celular. ( b ) Curva de inibição de diferença de estrutura: As células agrupadas tiveram inibição significativa, mas as células dispersas não tiveram inibição. ( c ) No dia 9, sob o mesmo volume e diferentes áreas basais, o número de células no grupo com áreas basais menores reduziu significativamente ( * P < 0,05, vs o grupo controle sem exposição; * P < 0,05, vs o grupo com área de frasco diferente) ( d ) Conforme mostrado na figura, as células se agruparam mais densamente no frasco de cultura, enquanto as células na placa de Petri estavam espalhadas no fundo devido ao baixo nível de líquido. ( e) Curva de crescimento diferencial da área inferior do recipiente de cultura no dia 9.
O potencial da membrana foi relacionado à inibição do campo magnético
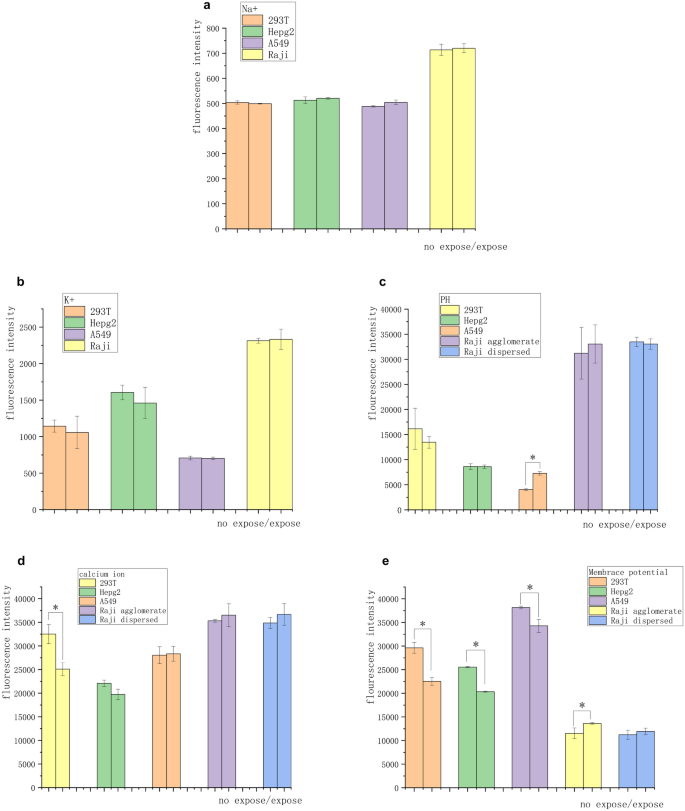
Os experimentos em células tumorais suspensas mostraram que o efeito inibitório do campo magnético em células cancerígenas foi realizado por meio do contato e da comunicação entre células, tendo implicações para a transmissão de sinais entre células e mudanças iônicas no microambiente celular. Os kits de cálcio, sódio, potássio e pH Calbryte 520 AM, SBFI AM, PBFI AM e BCECF AM foram usados para observar as mudanças em íons livres intracelulares de quatro tipos de células após 3 dias de exposição magnética, de modo a investigar se a supressão do campo magnético estava associada à sinalização iônica. Nenhuma mudança nas concentrações intracelulares de íons sódio e potássio foi observada em células normais ou tumorais (Fig. 4 a e b). Além disso, nenhuma diferença significativa foi encontrada na intensidade de fluorescência do pH em todos os grupos de células, exceto A549 (Fig. 4 c). Células T 293 normais mostraram uma diminuição significativa na concentração de íons cálcio livres intracelulares. As células tumorais sólidas não mostraram nenhuma mudança significativa, enquanto as células tumorais suspensas mostraram um ligeiro aumento na concentração de íons cálcio (Fig. 4 d).
Diferenças na força iônica e no potencial de membrana de células sob exposição de campo magnético de 5 mT e 20 Hz por 3 dias. ( a ) Nenhuma diferença significativa foi encontrada na intensidade de fluorescência dos íons sódio após 3 dias de exposição. ( b ) Nenhuma diferença significativa foi encontrada na intensidade de fluorescência dos íons potássio após exposição ao íon sódio por 3 dias. ( c) Após 3 dias de exposição, nenhuma diferença significativa foi encontrada na intensidade de fluorescência em todos os grupos de células, exceto A549. ( d ) A concentração de íons cálcio nas células T 293 diminuiu, enquanto nenhuma diferença significativa na concentração de íons cálcio foi observada nos outros grupos. ( e ) As células aderentes mostraram hiperpolarização significativa, os aglomerados de células tumorais mostraram despolarização significativa e as células tumorais livremente suspensas não mostraram despolarização significativa. Essas mudanças corresponderam às mudanças nas concentrações intracelulares de íons cálcio ( * P < 0,05, vs o grupo controle sem exposição).
Uma mudança na concentração iônica de cálcio é geralmente refletida por uma mudança no potencial de membrana. O kit de potencial de membrana DiBAC4 (3) foi usado para observar as células expostas no dia 3 com ΔIIF correspondendo à proporção da fluorescência do íon intracelular para o dia 3 e inicialmente. As células aderentes mostraram hiperpolarização significativa (células T ΔIIF 293: − 25%, células Hepg2 ΔIIF: − 20% e células A549 ΔIIF: − 13%). Os aglomerados de células tumorais mostraram despolarização significativa (células Raji ΔIIF: + 9%). As células tumorais suspensas livres não mostraram despolarização significativa (Fig. 4 e). As Figuras S1–S3 mostram dados de citometria de fluxo.
As células secretaram substâncias no meio condicionado, que interagiram com o campo magnético para inibir as células tumorais; a substância tinha expressão universal e era específica do tumor
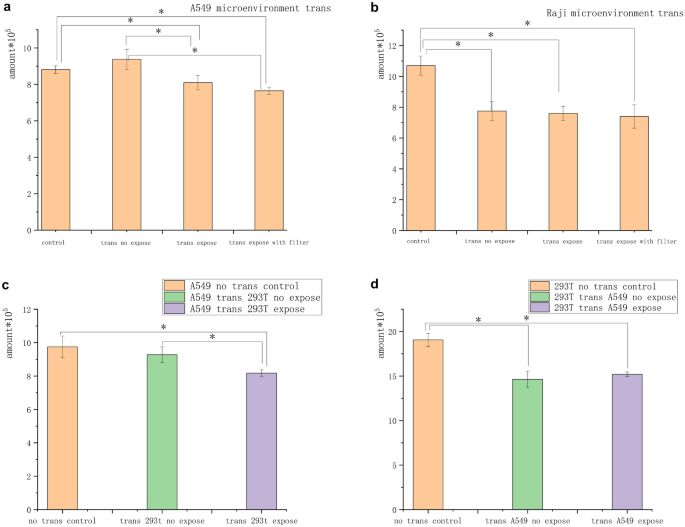
As células A549 e Raji em aglomerados foram expostas independentemente ao campo magnético de 5 mT por 3 h para determinar se a inibição do campo magnético estava relacionada a uma mudança no meio condicionado no estado de agregação celular. O meio condicionado foi então transferido para alimentar células não expostas da mesma espécie por 2 dias. O número de células no grupo A549 “transferência” foi de 4 × 10 5 . O número de células no grupo Raji “transferência” foi de 8 × 10 5 . O número de células no grupo A549 “ser transferido” foi de 2 × 10 5 . O número de células no grupo Raji “ser transferido” foi de 4 × 10 5 . Sob essas condições, as células no grupo A549 “ser transferido” foram significativamente inibidas a uma taxa de aproximadamente 10%, que foi quase a metade daquela das células com exposição direta no dia 1 no grupo de infusão de fluidos. As células no grupo Raji “ser transferido” não mostraram inibição, mas as células nos grupos de transferência foram inibidas em comparação com aquelas no grupo de controle não exposto (Fig. 5 a e b).
O meio condicionado inibiu o crescimento de células tumorais. ( a ) Após as células A549 serem expostas ao campo magnético, o meio condicionado foi filtrado e substituído pelo meio condicionado não exposto. O meio condicionado exposto A549 teve um efeito inibitório nas células A549 não expostas. ( b ) Após as células Raji serem expostas ao campo magnético, o meio condicionado foi filtrado e substituído pelo meio condicionado não exposto. Nenhuma diferença foi encontrada no número de células entre os grupos de mudança, mas o número de células no grupo de mudança foi significativamente menor do que no grupo de controle não tratado. ( c ) O número de células A549 transferidas do meio condicionado de células T 293 expostas reduziu significativamente em comparação com o controle não tratado e o meio condicionado não exposto. ( d ) Nenhuma diferença significativa foi encontrada no número de células T 293 no meio condicionado de células A549 após a exposição, em comparação com os grupos não tratados e não expostos ( * P < 0,05, vs o grupo controle sem exposição; * P < 0,05, vs grupo controle sem transferência).
Além disso, as células T A549 e 293 foram expostas ao campo magnético de 5 mT por 3 h para determinar se esse meio condicionado era exclusivo para células tumorais e inibia células normais. Os meios de cultura expostos foram então transferidos para alimentar células não expostas das diferentes espécies por 2 dias. Os resultados mostraram que as células A549 foram significativamente inibidas em meios de cultura 293 T. As células no grupo de transferência 293 T não mostraram inibição, mas as células em todos os grupos de transferência foram inibidas em comparação com aquelas no grupo de controle não exposto (Fig. 5 c e d).
Discussão
A exposição ao campo magnético tem o potencial de servir como uma estratégia avançada no tratamento do câncer. ROS produzidos por células usando esse método parecem ser a chave para a inibição do crescimento tumoral 3 . Nós provamos que o mecanismo principal não estava apenas relacionado a ROS, mas também intimamente relacionado ao contato entre células. Nós especulamos que a exposição ao campo magnético alterou a secreção de certos substratos, levando a mudanças na sinalização e, assim, restaurando a inibição do contato com células tumorais. Com base nos resultados experimentais e experimentos anteriores, quatro propriedades da supressão do campo magnético foram resumidas.
-
1.
Os experimentos sobre a inibição do campo magnético de células, especialmente células Raji, mostraram que o contato próximo entre células determinou diretamente se o efeito de inibição existia. Conforme mostrado nas Figs. 2 a, 3 a, e c, a agregação suspensa acelerou o crescimento de células tumorais suspensas, enquanto a exposição ao campo magnético inibiu o crescimento de células tumorais. Conforme mostrado na Fig. 3 c, a taxa de inibição do campo magnético variou no dia 9 dependendo da área do fundo do recipiente. O número de células expostas aglomeradas em uma área de 55 cm 2 foi significativamente maior do que em uma área de 25 cm 2 , mas nenhuma diferença significativa foi encontrada entre o número de células expostas aglomeradas e aquelas no grupo controle não exposto. Durante esse período, a inibição de células tumorais suspensas desapareceu, indicando que a distância entre os aglomerados de células se expandiu e o crescimento celular acelerou. Ao contrário, no grupo de 25 cm 2 frasco de cultura, a diferença no número de células entre os grupos exposto e controle aumentou significativamente, ou seja, a taxa de inibição aumentou. Isso indicou que as células tumorais recuperaram a inibição de contato sob exposição ao campo magnético. Portanto, a inibição do campo magnético exigiu contato próximo entre as células.
-
2.
O experimento com células aderentes mostrou que as células tumorais eram mais suscetíveis à inibição magnética usando meios condicionados mais adequados para o crescimento celular. Conforme mostrado na Fig. 1 b e c, o número de células tumorais no meio condicionado do grupo controle não exposto foi significativamente maior do que no meio fresco, enquanto o número de células tumorais no meio condicionado do grupo exposto foi significativamente menor do que no meio fresco (o efeito de inibição magnética foi significativamente maior no grupo de infusão do que no grupo de mudança). Foi sugerido que o meio condicionado era adequado não apenas para o crescimento exponencial de células na ausência do campo magnético, mas também para a comunicação entre células, o que aumentou o efeito de inibição de contato sob o campo magnético. Portanto, a taxa de inibição do campo magnético dependia da estabilidade do ambiente para estender a inibição de contato.
-
3.
Determinamos que certos substratos no meio condicionado também contribuíram para a inibição magnética. A inibição foi observada quando o meio condicionado do grupo de infusão (A549) foi transferido para células não expostas após a exposição ao campo magnético, demonstrando a presença de sinais de inibição no meio. As células tumorais suspensas foram menos sensíveis à inibição magnética em comparação com as células tumorais aderentes. Além disso, a agregação celular foi inevitavelmente afetada durante a transferência do meio condicionado. Portanto, mais design e consideração foram necessários para a transferência de meio condicional de suspensão de células tumorais.
Em um estudo de células xenogênicas no qual os meios condicionados de células normais 293 T e células tumorais A549 foram trocados e transferidos para células não expostas após exposição ao campo magnético, as células tumorais mostraram inibição enquanto as células normais não mostraram inibição significativa. Isso indicou que certos substratos interagindo com o campo magnético eram onipresentes em células sensíveis a células tumorais. A Figura 5 c e d indica que esses substratos também existiam em células não tumorais e não inibiam o crescimento de células não tumorais. Especulou-se que a capacidade de inibição de contato de células não tumorais não foi silenciada e, portanto, o crescimento de células não tumorais não foi inibido por essas substâncias. O número de células de controle sem transferência foi maior do que no grupo de transferência, possivelmente porque o meio de condição A549 não era adequado para o crescimento de células não tumorais. Com base nos resultados da inibição magnética reduzida após dispersão de células em suspensão ou separação de cluster, especulou-se que os substratos podem estar relacionados à comunicação intercelular e à inibição do contato celular. O sinal intercelular aumentou e a inibição de contato desapareceu quando as células foram suspensas e separadas ou os aglomerados estavam muito distantes. Portanto, as células secretaram um ou mais substratos, e os campos magnéticos de baixa frequência interagiram com células e substratos para inibir especificamente células tumorais.
A relação entre substâncias relevantes, meios condicionados e inibição de contato precisa de mais verificação experimental.
-
4.
Nossos experimentos in vitro de campo magnético de baixa frequência tiveram um ponto comum de que a eficiência de inibição magnética aumentou com o aumento do tempo de exposição quando as células se agruparam e o ambiente de cultura estava estável (meio condicionado do grupo de infusão), o que foi consistente com a maioria dos relatórios atuais. Enquanto isso, a maioria dos relatórios também sugeriu que a intensidade do campo magnético se correlacionou positivamente com a eficiência magnética. Portanto, a eficiência de supressão magnética se correlacionou positivamente com o tempo de exposição da intensidade do campo magnético 2 , 3 , 19 , 20 .
Para a exposição ao campo de baixa frequência, a coloração com azul de Trypan não revelou coloração celular óbvia e nenhuma diferença significativa na atividade celular, o que pode estar relacionado ao fato de que a morte celular não foi observada devido à coloração direta após o tratamento. Isso indicou que o campo magnético não matou células diretamente, mas induziu continuamente a apoptose; portanto, as células não foram coradas com azul de Trypan. Outros relatórios mostraram que a atividade da caspase-3 intracelular foi regulada positivamente e a integridade da membrana diminuiu após a exposição ao campo magnético 2 , 3 . Alguns relatórios revelaram que algumas células tumorais tinham eficiência de coloração 19 , o que pode estar relacionado ao tipo de célula e à seleção do tempo de detecção. A coloração com anexina V também mostrou uma inibição magnética progressiva. No entanto, o efeito variou de acordo com o tipo de célula 2 .
O efeito específico dos campos magnéticos na sinalização no ambiente celular ainda não está claro. A via de sinalização envolvida no campo magnético pode estar relacionada à inibição de contato e herança epigenética. Impulsionados por sinais celulares 1 , 22 , 27 , 28 , 29 , presumimos a presença de sinais elétricos entre células e íons de cálcio, que são o segundo mensageiro associado à divisão celular. Vários experimentos com sonda fluorescente mostraram que a mudança no potencial de membrana estava relacionada à exposição ao campo magnético, e a reação do potencial de membrana era diferente entre células aderentes e suspensas. O potencial de membrana de células aderentes tendia a ser hiperpolarizado sob o campo magnético. O potencial de membrana de células tumorais suspensas agrupadas tendia a despolarizar sob o campo magnético. Isso pode estar relacionado ao crescimento celular e à resposta de comunicação intercelular associada sob o campo magnético. Conforme mostrado na Fig. 3 c e e, células Raji suspensas e isoladas cresceram mais rápido sob o campo magnético. As descobertas da equipe de Yong Zhou 27 explicou esse fenômeno. A taxa de crescimento celular aumentou durante a despolarização, que envolveu a nanoagregação de interruptores k-Ras na superfície da membrana. As células tumorais suspensas se dispersaram umas com as outras, a sinalização intercelular por certas substâncias aumentou e a inibição do contato celular induzida pelo campo magnético desapareceu. Enquanto isso, o potencial da membrana celular das células tumorais suspensas foi despolarizado, o que acelerou o crescimento celular, e a inibição diminuiu ou desapareceu. O sinal de cálcio intracelular e o potencial de membrana com a mudança no campo magnético foram relativamente sincronizados (exceto A549). Nós hipotetizamos que a concentração de íons de cálcio estava associada ao potencial de membrana na exposição ao campo magnético. Além disso, apenas 293 células T mostraram diferenças significativas na concentração de íons de cálcio quando expostas ao campo magnético. Isso possivelmente estava relacionado à hipermetilação da rede de sinalização de cálcio associada ao tumor 30 . Atualmente, a relação entre a concentração de íons de cálcio e o potencial de membrana e o sinal de inibição do campo magnético não está clara. Além disso, o pH intracelular das células A549 aumentou sob o campo magnético. Isso pode estar relacionado ao fato de que as células A549 eram mais sensíveis ao campo magnético. Além disso, essa pode ser a razão pela qual a mudança de cálcio nas células A549 não foi sincronizada com o potencial de membrana.
Este estudo teve certas limitações. Nos experimentos em células tumorais suspensas, usamos uma pipeta para destruir a estrutura do cluster, e não conseguimos manter as células separadas o tempo todo durante a exposição ao campo magnético. Além disso, não conseguimos manter a agregação celular durante a transferência para recipientes maiores a cada 3 dias. Na detecção de íons e potencial de membrana, sabíamos que o potencial de membrana estava relacionado à exposição ao campo magnético. No entanto, o kit só conseguia medir o estado de um determinado período e, portanto, a detecção síncrona em tempo real é necessária para esclarecer a relação específica. Além disso, as mudanças no potencial de membrana também indicavam as mudanças nos sinais intracelulares. Portanto, especulou-se que o potencial de membrana poderia ser usado como meio para verificar o efeito inibitório do campo magnético nas células tumorais.
Combinar as quatro propriedades-chave mencionadas acima do efeito inibitório do campo magnético nas células pode servir como uma boa modalidade anticâncer adjuvante. Atualmente, a terapia de campo magnético tem ganhado cada vez mais atenção. Além disso, a universalidade dos sinais celulares com exposição ao campo magnético e o amplo espectro de tumores a tornam uma excelente metodologia para tratamento e prognóstico. Nossas descobertas, juntamente com outros relatórios, revelaram ainda mais o potencial da terapia de campo magnético. Nosso próximo estudo se concentrará nos mecanismos envolvidos em campos magnéticos, começando com substratos.
Métodos
Kit de teste
Um kit de sonda de cálcio Calbryte 520 AM (item n.º 20650) foi adquirido da AATBioquest (EUA). Tampão de Hanks com HEPES 20 mM (item n.º 20011) e sonda fluorescente de potencial de membrana DiBAC4 (3) (item n.º 21411) também foram adquiridos da AATBioquest. Uma sonda fluorescente de íon sódio SBFI (item n.º 18764) foi adquirida da Cayman Company (EUA). Uma sonda fluorescente de íon potássio PBFI (item n.º 21602) foi adquirida da Cayman Company. Pluronic F-127 (ST501-10G) foi adquirido da Beyotime Biotechnology.
Cultura de células
Células T 293, células Hepg2 e células A549 foram obtidas do Cell Bank da Academia Chinesa de Ciências (Xangai, China). As linhagens celulares foram cultivadas em DMEM (Biological Industries, Israel) com 10% de soro bovino fetal (FBS, ExCell Bio, China) e 1% de penicilina-estreptomicina (P/S, Industries, Israel). As células foram incubadas a 37 °C na presença de 5% de CO 2 . Todas as operações foram conduzidas dentro da bancada limpa de fluxo vertical.
As células Raji foram cultivadas no meio RPMI1640 (Biological Industries) com 10% de SFB e 1% de P/S. As células foram incubadas a 37 °C na presença de 5% de CO 2 . Todas as operações foram conduzidas dentro da bancada limpa de fluxo vertical.
Exposição e características do campo magnético
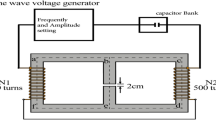
O gerador de campo magnético feito por ele mesmo converteu sinais elétricos em sinais de campo magnético por meio de um fio de cobre esmaltado (Fig. 6 , Fig. S4). O invólucro foi feito de material plástico de acrilonitrila butadieno estireno com especificações: 450 × 230 × 25 (C × P × A, mm 3 ). A saída do campo magnético pode ser alterada ajustando a frequência e a amplitude da tensão de alimentação do equipamento para o dispositivo gerador de campo magnético. O dispositivo gerador de campo magnético foi colocado em uma incubadora, e o campo magnético foi medido com um medidor de Gauss (TES 1393; TES Electrical Electronic Corp, Taiwan). As células do grupo não exposto foram colocadas na mesma incubadora (Thermo Scientific, EUA). A direção do campo magnético era perpendicular ao gerador de campo magnético. Durante todo o experimento, a intensidade do campo magnético disperso em cada incubadora foi menor que 0,02 mT (0–0,02 mT), e a temperatura foi ajustada para 37 ± 0,18 °C.
Contagem de células
Células aderentes: O sobrenadante foi coletado em um tubo de centrífuga e lavado duas vezes com solução salina normal. O sobrenadante limpo foi extraído, adicionado ao tubo de centrífuga e então digerido com tripsina (o tempo de digestão ideal variou de célula para célula: 293 T, 1 min; Hepg2, 1 min; A549, 2 min). A digestão foi encerrada no meio, e todas as células foram adicionadas ao tubo de centrífuga. Então, o furo foi limpo com solução salina normal muitas vezes e adicionado ao tubo de centrífuga. Neste momento, o tubo de centrífuga continha todas as células. Se as células foram deixadas no furo foi observado sob o microscópio.
Células suspensas: Todas as suspensões de células foram colocadas em um tubo de centrífuga. Os furos foram lavados com solução salina normal várias vezes e colocados no tubo de centrífuga. Neste momento, o tubo de centrífuga continha todas as células. Os poros foram observados para resíduos de células sob o microscópio.
Contagem: As células foram centrifugadas, ressuspensas em meio apropriado, diluídas parcialmente e coradas com azul de Trypan. Então, 10 µL dele foram injetados através da lamínula.
Fórmula de cálculo: Número de células/4 × volume × razão de diluição × 10 4 .
As células em cada grupo foram contadas três vezes para um total de três grupos.
Detecção do valor de pH
O corante fluorescente permeável à membrana BCECF AM e a sonda fluorescente sensível ao pH 2',7'-bis-(2-carboxietil)-5-carboxifluoresceína (Beyotime Biotechnology, China) foram usados para avaliar o valor do pH intracelular. As células foram cultivadas em placas de 96 poços e expostas a um campo magnético de 5 mT e 20 Hz por 2 h nos primeiros 2 dias. No dia 3, as células foram ressuspensas em 100 µL de 25 µM BCECF AM em solução de trabalho Pluronic F-127 a 0,04% e incubadas em um CO 2 incubadora a 37 ± 0,18 °C por 1 h. O sobrenadante foi substituído por tampão HHBS (AAT Bioquest, EUA), e as células foram submetidas à exposição ao campo magnético por 2 h. O sobrenadante foi então substituído por PBS, e os valores de pH foram determinados usando citometria de fluxo FITC (FACS Calibur, BD).
Ensaios de concentração de cálcio intracelular
O corante fluorescente permeável à membrana Calbryte 520 AM (AAT Bioquest) foi usado para avaliar a concentração de cálcio intracelular. As células foram cultivadas em placas de 96 poços e expostas a um campo magnético de 5 mT e 20 Hz por 2 h nos primeiros 2 dias. No dia 3, as células foram ressuspensas em 100 µL de 5 µM Calbryte 520 AM em solução de trabalho Pluronic F-127 a 0,04% e incubadas em um CO 2 incubadora a 37 ± 0,18 °C por 1 h. O sobrenadante foi substituído por tampão HHBS (AAT Bioquest), e as células foram expostas ao campo magnético por 2 h. O sobrenadante foi então substituído por PBS, e os valores de concentração de cálcio intracelular foram determinados usando citometria de fluxo FITC (FACS Calibur).
Determinação do potencial de membrana das células
O potencial de membrana foi determinado usando o corante fluorescente sensível ao potencial bis-(1,3-ácido dibutilbarbitúrico) trimetina oxonol (DiBAC4) (3) (AAT Bioquest). O corante fluorescente DiBAC4 (3) permeou as células despolarizadas com alto potencial de membrana, levando a um aumento na intensidade da fluorescência intracelular. DiBAC4 (3) foi descarregado das células hiperpolarizadas, e a intensidade da fluorescência intracelular diminuiu. As células foram cultivadas em placas de 96 poços e expostas a um campo magnético de 5 mT, 20 Hz por 2 h nos primeiros 2 dias. As células foram cultivadas em 100 µL de HHBS. No dia 3, as células foram ressuspensas em 100 µL de 10 µM DIBAC4 (3) AM em solução de trabalho Pluronic F-127 a 0,04% e incubadas em um CO 2 incubadora a 37 ± 0,18 °C por 1 h. O sobrenadante foi substituído por tampão HHBS (AAT Bioquest), e as células foram expostas ao campo magnético por 2 h. O sobrenadante foi então substituído por PBS, e os potenciais de membrana celular foram determinados usando citometria de fluxo FITC (FACS Calibur).
Detecção de íons de sódio
As células foram cultivadas em placas de 96 poços e expostas a um campo magnético de 5 mT, 20 Hz por 2 h nos primeiros 2 dias. No dia 3, o meio foi substituído por 100 µL de HHBS e 100 µL de 10 µM SBFI AM (Cayman Chemical) em uma solução de trabalho Pluronic F-127 a 0,04%. O sobrenadante foi substituído por tampão HHBS (AAT Bioquest) após 4 h de incubação em um CO 2 incubadora a 37 ± 0,18 °C, e as células foram expostas ao campo magnético por 2 h. O íon sódio foi determinado em excitação 330/80 e emissão 528/20 usando um testador de microplacas.
Detecção de íons de potássio
As células foram cultivadas em placas de 96 poços e expostas a um campo magnético de 5 mT, 20 Hz por 2 h nos primeiros 2 dias. No dia 3, o meio foi substituído por 100 µL de HHBS e 100 µL de 10 µM PBFI AM (Cayman Chemical) em uma solução de trabalho Pluronic F-127 a 0,04%. Após 4 h de incubação em um CO 2 incubadora a 37 ± 0,18 °C, o sobrenadante foi substituído por tampão HHBS (AAT Bioquest), e as células foram expostas ao campo magnético por 2 h. A determinação do íon potássio foi conduzida em excitação 330/80 e emissão 528/20 usando um testador de microplacas.
Tingimento com azul de tripano
293 células T, Hepg2 e A549 na fase de crescimento logarítmico foram digeridas com tripsina e colhidas. As células Raji foram coletadas diretamente. Após a centrifugação, as células foram coradas com o corante vital azul de tripano. As células vivas foram contadas em um microscópio de luz invertida (Carl Zeiss, Alemanha). As taxas de inibição do crescimento celular foram determinadas e curvas representativas foram plotadas. Taxa de inibição (%) = (número de células no grupo controle − número de células no grupo do campo magnético) / número de células no grupo controle × 100%.
Análise estatística
Todos os dados foram expressos como média ± erro padrão da média, e a análise de variância unidirecional foi usada para comparação entre vários grupos. O aluno para teste foi usado para comparar os grupos tratados versus não tratados. Um P valor < 0,05 indicou uma diferença estatisticamente significativa. Os resultados confirmatórios em P < 0,05 foram obtidos a partir da repetição de estudos pelo menos duas vezes. Cada conjunto de experimentos tinha três amostras paralelas e cada experimento foi repetido três vezes.